Filariasis; generalidades y actualizacion sobre su conocimiento
Las filarias tienen sustancias alérgenas que dan lugar a reacciones inflamatorias en el organismo convirtiendo la zona en una cicatriz que, en ocasiones, es responsable de los síntomas. Éste es el caso de la elefantiasis, ya que la obstrucción de los conductos linfáticos provoca edema en las piernas.
OMS
Definición
Se denomina filariasis a un grupo de enfermedades producidas por parásitos, generalmente tropicales, nematodos, que se transmiten en forma de larva a los vertebrados mediante la picadura de un mosquito o una mosca. Es causada por filarias, es decir, los parásitos nematodos del orden Filariidae [1] De los cientos de parásitos filarial descritos, sólo 8 especies causan infecciones naturales en los seres humanos.. La Organización Mundial de la Salud (OMS) ha identificado la filariasis linfática como la segunda causa de discapacidad permanente y de largo plazo en el mundo, después de la lepra.
Historia
Se sabe que ya había casos de filariasis hace más de 3.000 años, y algunas descripciones en libros egipcios de Medicina parecen corresponder a esta enfermedad. En el mundo moderno, en el siglo XVI, Jan Huygen Linschoten, un explorador que visitó Goa, describió la enfermedad, aunque no fue hasta el siglo XIX cuando se obtuvo la conexión entre la filaria y la elefantiasis y se demostró la presencia de los gusanos en los mosquitos.
El hombre es el reservorio y la fuente de infección primaria para todas las filariasis humanas. Su mecanismo de transmisión se produce por hospedadores intermediarios, que cogen el parásito de la sangre de un individuo y se lo transmiten a otro mediante una picadura. Los artrópodos que transmiten la enfermedad varían en función del parásito.
Las filarias producen enfermedad porque tienen sustancias alérgenas que dan lugar a reacciones inflamatorias en el organismo. Las microfilarias se mueven llegando a diversas áreas y tejidos, incluido el ojo (como ocurre en el caso de la oncocercosis). La reacción inflamatoria que se produce en el organismo en respuesta a la presencia del gusano se localiza alrededor del parásito adulto, convirtiendo la zona en una cicatriz que, en ocasiones, es responsable de los síntomas. Éste es el caso de la elefantiasis, ya que la obstrucción de los conductos linfáticos provoca hinchazón en las piernas.
Generalmente, la enfermedad se contrae en la infancia, aunque suele tardar muchos años en dar síntomas, e incluso algunos individuos no llegan a tenerlos nunca. Los pacientes asintomáticos son, sin embargo, fuente de infección para otros pacientes. En la sangre de estos individuos suele haber cientos o millones de larvas y gusanos adultos circulando por el sistema linfático.
La enfermedad como tal según la OMS
La filariasis linfática, conocida generalmente como elefantiasis, es una enfermedad tropical desatendida. La infección humana se produce por la transmisión de unos parásitos denominados filarias a través de los mosquitos. Cuando un mosquito que contiene larvas en estado infectivo pica a una persona deposita los parásitos en la piel. Desde ahí las larvas invaden el organismo, migrando hacia los vasos linfáticos donde se desarrollan y transforman en gusanos adultos en el sistema linfático.
La infección suele adquirirse en la infancia, pero las manifestaciones dolorosas y muy desfigurantes de la enfermedad aparecen más tarde. Mientras que los episodios agudos de la enfermedad causan discapacidad transitoria, la filariasis linfática produce discapacidad permanente.
En la actualidad hay más de 1300 millones de personas de 72 países en riesgo de contraer esta enfermedad. Aproximadamente un 65% de los infectados viven en la Región de Asia Sudoriental, el 30% en la Región de África, y los demás en otras zonas tropicales.
La filariasis linfática afecta a más de 25 millones de hombres con enfermedad genital y a más de 15 millones de personas con linfedema. Como la prevalencia de la enfermedad y la intensidad de la infección están relacionadas con la pobreza, su eliminación puede contribuir a alcanzar los Objetivos de Desarrollo del Milenio de las Naciones Unidas.
Etiología y transmisión
La filariasis linfática es causada por la infección por nematodos de la familia Filarioidea. Hay tres tipos de estos gusanos filiformes:
- Wuchereria bancrofti, que es responsable del 90% de los casos;
- Brugia malayi, que causa la mayoría de los casos restantes;
- B. timori, que también causa la enfermedad.
Los gusanos adultos se alojan en el sistema linfático y alteran el sistema inmunitario. Estos gusanos viven entre 6 y 8 años, y a lo largo de su vida producen millones de pequeñas larvas (microfilarias) que circulan en la sangre.
La filariasis linfática es transmitida por diferentes tipos de mosquitos, entre ellos: Culex, que está muy extendido en las zonas urbanas y semiurbanas; Anopheles, que está presente principalmente en las zonas rurales, y Aedes, que predomina en las islas endémicas del Pacífico. Los mosquitos de los géneros Aedes, Anopheles, Culex o Mansonia son los huéspedes intermediarios y vectores de todas las especies que causan filariasis linfática.
Filariasis linfática aguda se relaciona con la muda larval y la maduración de las larvas adultas quinta etapa. Los gusanos adultos se encuentran en los ganglios linfáticos y los vasos linfáticos distales a los nodos. Las hembras miden 80 a 100 mm de longitud y los machos son 40 mm.
Los nodos más comúnmente afectadas son las regiones femorales y epitrocleares. Formación de absceso puede ocurrir en los nodos o en cualquier lugar a lo largo del vaso distal. La infección con B Timori parece resultar en más abscesos que la infección con B malayi o W bancrofti. (Ver la imagen de abajo.)
Filarial cicatriz absceso en la parte superior del muslo izquierdo en un varón joven que es positivo para Wuchereria bancrofti microfilarias
Invasión celular con células plasmáticas, eosinófilos y macrófagos, junto con hiperplasia del endotelio linfático, se producen con episodios inflamatorios repetidos. La consecuencia es el daño linfático y pérdida crónica de la rica en proteínas linfáticas en los tejidos, engrosamiento y cambios verrugosas de la piel, e infecciones estreptocócicas y fúngicas crónicas, que contribuyen a la aparición de la elefantiasis. (La piel de las personas con elefantiasis se caracteriza por hiperqueratosis, acantosis, la linfa y el tejido graso, la pérdida de las fibras de elastina y la fibrosis.)
B. malayi elefantiasis es más probable que afecte las extremidades superiores e inferiores, siendo rara la patología genital y quiluria. Infección bacteriana secundaria de la elefantiasis puede resultar en ceguera.
Filariasis oculta
Denota la filariasis en la que las microfilarias no se observaron en la sangre, pero puede encontrarse en otros fluidos corporales y / o tejidos.
Los síndromes de filariasis ocultas son las siguientes:
Eosinofilia pulmonar tropical (TPE) - muy probablemente el resultado de una hipersensibilidad a W. bancrofti o antígeno malayi, los síntomas resultan de reacciones alérgicas e inflamatorias provocada por las microfilarias y antígenos de parásitos que los pulmones limpios de la sangre
D. immitis o infección D. repens - La infección humana por D. immitis puede provocar lesiones pulmonares de gusanos Dirofilaria inmaduras en la periferia del pulmón, y si D immitis lodge larvas en las ramas de las arterias pulmonares, que pueden causar infartos pulmonares.
-Artritis Filarial
-Absceso mamario Filarial
-Filaria asociada a glomerulonefritis por complejos inmunes
Oncocercosis
O volvulus microfilarias de la piel son ingeridas por las especies de mosca negra Simulium. Oncocercosis casos crónicos son hipersensibles al antígeno del parásito, han aumentado eosinofilia, y el resultado en la presencia de altos niveles de IgE en suero. Los patrones de la oftalmía por Onchocerca también se asocian con diferencias de las cepas de parásitos a nivel del ADN. [18]
Loiasis
Mango moscas o tábanos de Chrysops transmiten loiasis. Respuesta a la infección L loa parece diferir entre residentes y no residentes en áreas endémicas. No residentes con infección parecen ser más propensos a síntomas que los residentes, a pesar de los niveles más bajos de microfilaremia. Eosinófilos, IgE en suero, y los niveles de anticuerpos también son más altos en los no residentes con infección. (Ver la imagen de abajo). [19]
Filariasis. Microfilarias de Loa loa detectado en muestras de piel.
Meningoencefalopatía por L. loa
Meningoencefalopatía es una complicación grave y a menudo fatal de la infección. Este síndrome suele ser relacionado con la administración dietilcarbamazina (DEC) en individuos con microfilaremia de alta densidad, pero puede ocurrir sin tratamiento farmacológico. [20]
La DEC provoca una gran afluencia de microfilarias en el líquido cefalorraquídeo, lo que lleva a la obstrucción capilar, edema cerebral, hipoxia, y coma. Granulomas necrotizantes localizadas también están presentes, en respuesta a las microfilarias. La fibrosis endomiocárdica, síndrome nefrítico, y trombosis venosa también se pueden observar.
Epidemiología
Datos y cifras
- En el mundo hay más de 1300 millones de personas de 72 países en riesgo de sufrir filariasis linfática, generalmente conocida como elefantiasis.
- En la actualidad hay más de 120 millones de personas infectadas, y unos 40 millones están desfiguradas e incapacitadas por la enfermedad.
- La filariasis linfática puede alterar el sistema linfático y producir una hipertrofia anormal de algunas partes del cuerpo, dolor y discapacidad grave.
- El linfedema crónico suele acompañarse de episodios agudos de inflamación local de la piel y de los ganglios y vasos linfáticos.
- Para interrumpir la transmisión la OMS recomienda la administración anual de dosis únicas de dos medicamentos a todas las personas de las zonas endémicas que cumplan los criterios para recibirlas (la llamada farmacoterapia colectiva).
Ocurrencia en los Estados Unidos
Ninguna forma de filariasis humana es actualmente endémica en los Estados Unidos. W bancrofti fue una vez prevalente en Charleston, Carolina del Sur, debido a la presencia de mosquitos vectores adecuados. Las poblaciones inmigrantes y las personas que han viajado a largo plazo a los trópicos son potenciales focos de infección.
Devolución de misioneros y voluntarios del Cuerpo de Paz están en riesgo particular para la filariasis linfática y la oncocercosis, debido al período prepatente largo y relativamente alta intensidad de exposición necesario entre la exposición a las picaduras de insectos infecciosos y el desarrollo de los gusanos adultos sexualmente maduros.
Dos casos de oncocercosis oculares han sido reportados en los Estados Unidos, [21] como tiene un solo caso de la masa espinal en un niño pequeño debido a la infección por Onchocerca lupi. [22]
Ocurrencia Internacional
La filariasis linfática afecta a más de 90 millones de personas en todo el mundo y se encuentra en los trópicos y subtrópicos. Al menos 21 millones de personas están infectadas con O volvulus en África ecuatorial y focos en América Central y del Sur. Aproximadamente 3 millones de personas en el África central están infectadas con L loa. En 1997, la Organización Mundial de la Salud (OMS) puso en marcha un programa para eliminar globalmente filariasis linfática como problema de salud pública. [23, 19]
Sexo y datos demográficos relacionados con la edad
Ambos sexos son igualmente susceptibles a la filariasis. Debido a las diferentes prácticas locales y culturales, sin embargo, así como las diferencias en la exposición a los insectos vectores, uno u otro sexo pueden estar expuestos a la infección con más frecuencia.
Las personas de todas las edades son susceptibles a la infección y son potencialmente microfilaremic. Tasas microfilaremia aumentan con la edad durante la infancia y la adultez temprana, aunque la infección clínica puede no ser evidente. La manifestación de la filariasis aguda y crónica por lo general sólo se produce después de años de exposición repetida e intensa a vectores infectados en áreas endémicas.
Fisiopatología
El ciclo de vida filaria, como la de todos los nematodos, se compone de 5 fases de desarrollo (larvas) en una serie vertebral y un huésped intermediario y artrópodos vectores. Gusanos hembras adultas producen miles de larvas de primera etapa o microfilarias, que son ingeridas por un insecto vector alimentación. Algunos microfilarias tiene un único periodicidad diaria circadiano en la circulación periférica. Los artrópodos vectores (mosquitos y moscas) también tienen un ritmo circadiano en la cual obtienen harinas de sangre. La mayor concentración de microfilarias por lo general ocurre cuando el vector local es la alimentación más activa. [9]
Las microfilarias se someten a 2 cambios en el desarrollo del insecto. Las larvas de tercer estadio a continuación, se inoculan de nuevo en el anfitrión vertebral durante el acto de la alimentación para los últimos 2 etapas de desarrollo. Estas larvas viajan a través de la dermis y entrar a los vasos linfáticos regionales. Durante los próximos 9 meses, las larvas se convierten en gusanos maduros (20 a 100 mm de longitud). Un parásito promedio puede sobrevivir por cerca de 5 años.
El período prepatente se define como el intervalo entre un bocado vector y la aparición de microfilarias en la sangre, con una duración estimada de aproximadamente 12 meses.
Los siguientes factores influyen en la patogénesis de la filariasis:
- La cantidad de acumulación de antígeno gusano adulto en los vasos linfáticos [10]
- La duración y el nivel de exposición a las picaduras de insectos infecciosos [11]
- El número de infecciones bacterianas y fúngicas secundarias [10]
- El grado de respuesta inmune del huésped [12]
Filariasis genera respuestas inmunes inflamatorias importantes que participan en el desarrollo de la obstrucción linfática sintomático. Aumento de los niveles de inmunoglobulina E (IgE) y la inmunoglobulina G4 (IgG4) secundaria a antigénico (de gusanos muertos) la estimulación de la respuesta inmune de tipo Th2 se ha demostrado.
Los estudios han demostrado que existe una tendencia familiar a la obstrucción linfática, proporcionando apoyo a la hipótesis de que los genes del huésped influyen en la susceptibilidad linfedema. [13] Los estudios también sugieren que la microfilaremia puede ser incrementado en los individuos con bajos niveles de lectina de unión a manosa, lo que sugiere una genética predisposición. [14] Además, una propensión a desarrollar la enfermedad crónica se ha demostrado en pacientes con polimorfismos de la endotelina-1 y factor de necrosis tumoral receptor de II. [15]
La exposición prenatal parece ser un factor determinante para conferir una mayor tolerancia inmune al antígeno del parásito. [16] Por lo tanto, las personas procedentes de zonas endémicas son a menudo asintomáticos hasta tarde en la enfermedad cuando tienen alta carga de gusanos, mientras que los expatriados no inmunes tienden a tener las respuestas inmunes a paso ligero y síntomas más severos principios clínicos, incluso en infecciones leves.
Los estudios han demostrado que los parásitos de filarias linfáticas contienen rickettsialike bacteria Wolbachia endosimbiontes. Esta asociación ha sido reconocido como una contribución a la reacción inflamatoria observada en la filariasis. [17]
Historia clínica
Los síntomas de la filariasis dependen de las especies y el tipo de cuerpo y puede ser aguda o crónica en la naturaleza. Hasta el 70% de los individuos infectados permanecen asintomáticos. Los síntomas generalmente no se manifiestan hasta la adolescencia o la edad adulta, cuando la carga parasitaria es por lo general el más alto. Se han observado varias variaciones. [24]
Debido a que los casos de filariasis en el mundo industrializado y el Hemisferio Occidental no son comunes, el diagnóstico inicial se puede perder. Para evitar este escollo, obtener y documentar un historial de viajes de pacientes con lesiones sospechosas.
Filariasis linfática
El curso clínico de la filariasis linfática se divide ampliamente en lo siguiente:
-Microfilaremia asintomática: Los pacientes con microfilaremia son generalmente asintomáticos, aunque aquellos con cargas pesadas de microfilarias pueden desarrollar granulomas inflamatorios agudos y crónicos secundarios a la destrucción del bazo; paso de nubes, orina lechosa puede denotar quiluria.
-Fases agudas de adenolymphangitis (ADL)
-Crónica, irreversible linfedema
Los síntomas de la filariasis linfática principalmente como resultado de la presencia de los gusanos adultos que residen en el sistema linfático. Estos incluyen los siguientes:
- Fiebre
- Adenopatía inguinal o axilar
- Testicular y / o dolor inguinal
- Exfoliación de la piel
- La integridad o la hinchazón genital
Los siguientes síndromes agudos se han descrito en la filariasis:
- Agudo ADL
- Fiebre Filarial - Se caracteriza por fiebre sin adenitis asociado
- Tropical eosinofilia pulmonar (TPE)
- Agudo ADL
Esto se refiere a la aparición repentina de fiebre, linfadenopatía dolorosa. Histológicamente, el ganglio linfático se caracteriza por una linfangitis retrógrada, distinguiéndola de linfadenitis bacteriana. Los síntomas por lo general desaparecen en 1 semana, pero las recidivas son posibles. [25]
Los signos y síntomas de la ADL incluyen ataques episódicos de fiebre asociados con la inflamación de los ganglios linfáticos inguinales, testículos y cordón espermático, así como con linfedema. Exfoliación de la piel de la parte del cuerpo afectada por lo general ocurre con la resolución de un episodio.
Eosinofilia pulmonar tropical
TPE es una forma de filariasis oculta. Los síntomas de presentación incluyen una tos seca y paroxística, sibilancias, disnea, anorexia, malestar general y pérdida de peso.
Los síntomas de la TPE son por lo general debido a la respuesta inflamatoria a la infección. Característicamente, se observan eosinofilia en sangre periférica y hallazgos anormales en la radiografía de tórax. TPE suele estar relacionada con W bancrofti o infección B malayi.
Oncocercosis
Esto también se conoce como las ingles colgantes, piel del leopardo, la oncocercosis, o sowda. Los síntomas resultan de la presencia de microfilarias en la piel e incluyen prurito, nódulos subcutáneos, linfadenitis y ceguera.
Los pacientes con oncocercosis pueden reportar el deterioro de la agudeza visual debido a la fibrosis corneal. La epilepsia se ha asociado con la oncocercosis en algunos estudios. [26]
Loiasis
Los síntomas de la infección L loa suelen limitarse a hinchazones subcutánea en las extremidades, dolor localizado, prurito y urticaria.
Manifestaciones poco comunes de infección incluyen las siguientes:
- Artritis
- Calcificación de mama
- Meningoencefalopatía
- Fibrosis endomiocárdica
- Neuropatía periférica
- Derrames pleurales
- Retinopatía
M ozzardi, M perstans e infección M streptocerca
Mansonella infecciones son generalmente asintomáticas. Si los síntomas están presentes, pueden incluir fiebre, prurito, nódulos cutáneos, linfadenitis, y dolor abdominal.
Infección por Dirofilaria
Los síntomas de la infección por D. immitis involucran al sistema respiratorio e incluyen dolor de pecho, tos, fiebre y hemoptisis.
Los síntomas de la infección por D. repens usualmente incluyen un bulto en el tejido subcutáneo, submucosa, o el párpado.
Signos y síntomas
Síntomas
La filariasis linfática adopta formas asintomáticas, agudas y crónicas. La mayoría de las infecciones son asintomáticas y no presentan signos externos. A pesar de ello dañan el sistema linfático, los riñones y el sistema inmunitario.
El linfedema crónico, o elefantiasis, se acompaña a menudo de episodios agudos de inflamación local de la piel y de los ganglios y los vasos linfáticos. Algunos de esos episodios son causados por la respuesta inmunitaria del organismo contra el parásito. Sin embargo, la mayoría se debe a infecciones bacterianas cutáneas porque las defensas normales se han deteriorado debido al daño linfático.
Cuando la filariasis linfática se vuelve crónica produce linfedema (tumefacción de los tejidos) o elefantiasis (engrosamiento de la piel) de los miembros e hidrocele (acumulación de líquidos). Es frecuente la afectación de las mamas y de los órganos genitales.
Estas deformidades son causa de estigmatización social y de dificultades económicas debidas a la pérdida de ingresos y al aumento de los gastos médicos. La carga socioeconómica del aislamiento y la pobreza es enorme.
Los síntomas, que afectan más a los hombres que a las mujeres, pueden ser muy variados. El caso más espectacular es la filariasis linfática o elefantiasis, un engrosamiento de la piel y tejido subcutáneo provocado por la obstrucción del sistema linfático por los gusanos. Suele afectar a las extremidades inferiores, aunque algunas especies tienen predilección por los genitales. La 'Oncocerca volvulus', un tipo de filaria que migra hasta los ojos, puede producir ceguera cuando llega a la córnea.
La filariasis linfática
- Fiebre
- Adenopatía inguinal o axilar
- Testicular y / o dolor inguinal
- Exfoliación de la piel
- La integridad o la hinchazón genital - episodios repetidos de inflamación y del linfedema llevarán a un daño linfático, inflamación crónica, y la elefantiasis de las piernas, los brazos, el escroto, vulva y los pechos.
Los siguientes síndromes agudos se han descrito en la filariasis:
- Adenolinfangitis aguda (ADL)
- Fiebre Filarial - Se caracteriza por fiebre sin adenitis asociado
- Eosinofilia pulmonar tropical (TPE)
Oncocercosis
La tríada clínica de la infección en la oncocercosis es la siguiente:
Dermatitis - Lesiones en la piel incluyen edema, prurito, eritema, pápulas, erupciones scablike, pigmentación alterada y liquenificación
Nódulos de la piel (es decir, onchocercomas) - nódulos en la piel tienden a ser comunes sobre las prominencias óseas
Las lesiones oculares - lesiones oculares suelen estar relacionados con la duración y la gravedad de la infección y son causadas por una respuesta inmunitaria del huésped anormal microfilarias, se puede producir la pérdida de la agudeza visual
Loiasis
La característica de diagnóstico de loaiasis es una hinchazón, es decir, un área grande, transitoria y localizada de edema subcutáneo. Esto es más común en las articulaciones.
Infecciones Mansonella
Estos suelen ser asintomáticos. Si los síntomas están presentes, pueden incluir fiebre, prurito, nódulos cutáneos, linfadenitis, y dolor abdominal.
Examen físico
Los signos de la filariasis en la exploración son especies que dependen de y puede ser aguda o crónica en la naturaleza.
La filariasis linfática: En la filariasis linfática, los episodios repetidos de inflamación y el linfedema conducen al daño linfático, inflamación crónica, y la elefantiasis de las piernas, los brazos, el escroto, vulva y los pechos. (Ver las imágenes de abajo.) [27, 28, 29, 30, 31, 14]
La filariasis linfática como resultado de la infección por Wuchereria bancrofti, que está causando linfedema de la extremidad, adenopatía inguinal, e hidrocele. Fotografía tomada por el Profesor Bruce McMillan y donado por John Walker, MD.
Filariasis. Unilateral pierna izquierda elefantiasis secundaria a la infección por Wuchereria bancrofti en un niño.
Filariasis. Esta es una vista de primer plano de la parte inferior elefantiasis pierna unilateral se muestra en la Imagen 4. Tenga en cuenta el linfedema y la apariencia de la piel típica de despigmentación y verrucosities (cambios verrugas).
Filariasis. Vista lateral de la cara externa derecha de una pierna afectada por la elefantiasis bruto secundaria a la infección Wuchereria bancrofti.
Filariasis. Aspecto interior de la pierna del paciente de sexo masculino en la Imagen 6, que muestra la elefantiasis bruto secundaria a la infección Wuchereria bancrofti.
Filariasis. Hidrocele izquierdo unilateral y agrandamiento testicular secundaria a la infección por Wuchereria bancrofti en un hombre que también fue positiva para microfilarias.
Filariasis. Hidrocele bilateral, agrandamiento testicular y linfadenopatía inguinal secundaria a la infección Wuchereria bancrofti en un hombre que también era microfilaremic.
La OMS ha desarrollado un sistema para clasificar la gravedad del edema, de la siguiente manera [5]:
Grado 1 - Edema con fóvea reversible con la elevación de la extremidad
Grado 2 - edema sin fóvea irreversible con la elevación del miembro
Grado 3 - Hinchazón severa con esclerosis y cambios en la piel
Hidrocele es la manifestación más común de la infección crónica por W bancrofti en los hombres en las zonas endémicas, pero es poco frecuente, con B malayi y la infección B timori.
Quiluria también puede estar presente en personas crónicamente infectadas. Dado que una gran cantidad de grasa y proteína se pierden en la orina, estas condiciones pueden llevar a deficiencias nutricionales.
Eosinofilia pulmonar tropical: Sibilancias dispersas y crujidos se escuchan en ambos campos pulmonares. Linfadenopatía y hepatomegalia pueden estar presentes.
Oncocercosis
La tríada clínica de la infección es la siguiente:
- Dermatitis - Lesiones en la piel incluyen edema, prurito, eritema, pápulas, erupciones scablike, pigmentación alterada y liquenificación
- Nódulos de la piel (es decir, onchocercomas) - nódulos en la piel tienden a ser comunes sobre las prominencias óseas (ver imagen a continuación)
Filariasis. Onchocercomas de la piel del antebrazo (sowda) en un hombre sudanés.
- Las lesiones oculares - lesiones oculares suelen estar relacionados con la duración y la gravedad de la infección y son causadas por una respuesta inmunitaria del huésped anormal microfilarias, se puede producir la pérdida de la agudeza visual
Hallazgos oculares comunes en la oncocercosis son los siguientes:
- Queratitis punteada
- La formación de pannus
- Fibrosis corneal
- Iridociclitis
- Glaucoma
- Coroiditis
- Atrofia óptica
- Loiasis
La característica de diagnóstico de loaiasis es un Calabar hinchazón, es decir, un área grande, transitoria de localizada, nonerythematous edema subcutáneo. Esto es más común en las articulaciones.
Compromiso de los nervios periféricos en loiasis se ha descrito [32]. Microfilaremia suele ser asintomática. En ocasiones, el gusano se observa la migración a través subconjuntivales u otros tejidos.
M ozzardi, M perstans e infección M streptocerca
Se localizan a nivel subcutáneo o nódulos conjuntivales y linfadenopatía, pueden ser detectados en personas sintomáticas.
Infección por Dirofilaria
Estas infecciones se caracterizan de la siguiente manera:
D infección repens - Puede provocar dolor subcutánea, submucosa, o bultos párpado
Infección D immitis - Reducida la entrada de aire localizada en la auscultación del tórax puede ser detectada
Diagnóstico
El diagnóstico de esta patología ha sido complejo hasta hace poco tiempo, ya que era preciso ver a los parásitos en la sangre mediante el microscópico, pero éstos no suelen salir al torrente sanguíneo más que por la noche, y por ello era complicado tomar una muestra en la que se vieran gusanos. Hoy en día, existen técnicas que detectan la presencia de antígenos circulantes, mediante un test sencillo que sólo precisa una gota de sangre que se puede coger con un 'pinchazo' en un dedo.
Diagnostico diferencial
Las diferencias en el diagnóstico de filariasis son los siguientes:
- Aspergilosis broncopulmonar alérgica
- Vasculitis sistémicas
- Neumonía eosinofílica crónica
- Síndrome hipereosinofílico idiopático
- Glomerulonefritis post-estreptocócica aguda
La filariasis linfática
Las diferencias en el diagnóstico de la filariasis linfática son las siguientes [33]:
- Linfadenitis bacteriana o micótica - Por ejemplo, la esporotricosis resultante de la infección por Sporothrix schenckii
- Linfadenitis estreptocócica recurrente - Es decir, la erisipela recurrente
- Linfedema congénita o hereditaria - Por ejemplo, el síndrome de Milroy
- Elefantiasis no filarial - Tierras Altas de África Oriental
- Hidrocele congénito
- Quistes de epidídimo
- El carcinoma de testículo y / o en el escroto
- Linfosarcoma
- Filariasis oculta
Las diferencias en el diagnóstico de filariasis oculta son los siguientes:
- Asma
- Monoartritis bacteriana
- Absceso mamario bacteriana
- Glomerulonefritis post-estreptocócica ó Idiopática
- Otro
Los diferenciales también se incluyen los siguientes:
- Oncocercosis - Vitiligo, el tracoma, la lepra lepromatosa
- Loiasis - hereditaria y / o localizada idiopática angioedema
Diagnóstico diferencial
- Angioedema
- Asma
- Enfermedad de Hodgkin
- Hidrocele
- Lepra
- Linfedema
- Linfoma no Hodgkin
- Trauma escrotal
- Trauma testicular
Laboratorio
El método de diagnóstico tradicional para la filariasis es demostrar microfilarias en la sangre periférica o de la piel. Por ejemplo, las microfilarias de todas las especies que causan la filariasis linfática y la microfilarias de loa L, M ozzardi, y M perstans se detectan en la sangre. [2]
O vólvulo y M infecciones streptocerca son diagnosticados cuando microfilarias se detectan en múltiples especímenes snip piel de diferentes sitios ubicados en ambos lados del cuerpo. Además, microfilarias de O vólvulo puede ser detectado en la cámara de córnea o anterior del ojo, el uso de examen con lámpara de hendidura.
Examen de orina y microscopía: Microfilarias también se puede observar en la orina quilosa hidrocele y líquido. Si se sospecha de la filariasis linfática, la orina se debe examinar macroscópicamente la quiluria y después se concentró para examinar de microfilarias.
La detección de microfilarias en la piel y los ojos
Piel
O vólvulo y M streptocerca son diagnosticados cuando las infecciones por microfilarias se detectan en múltiples muestras de piel de los diferentes sitios situados a ambos lados del cuerpo.
En los casos sospechosos de la oncocercosis africana, los sitios recomendados para muestras de piel son los glúteos y pantorrillas. Para oncocercosis americana, se prefieren la escápula y la piel deltoides.
Prueba de Mazzotti: La prueba de Mazzotti permite un diagnóstico presuntivo de la filariasis cutánea que se produce cuando muestras de piel son negativos para microfilarias.
Un intenso prurito se suscitó en cuestión de horas después de una sola dosis pequeña de diciembre (50-100 mg). Los esteroides pueden ser necesarios para controlar esta reacción inflamatoria.
La prueba debe ser utilizado con precaución en personas que pueden estar infectadas en gran medida, debido a una reacción sistémica grave puede ser provocado. Una prueba de parches para DEC que causa una reacción localizada de la piel se puede utilizar en tales pacientes.
Un intenso prurito se suscitó en cuestión de horas después de una sola dosis pequeña de diciembre (50-100 mg). Los esteroides pueden ser necesarios para controlar esta reacción inflamatoria.
La prueba debe ser utilizado con precaución en personas que pueden estar infectadas en gran medida, debido a una reacción sistémica grave puede ser provocado. Una prueba de parches para DEC que causa una reacción localizada de la piel se puede utilizar en tales pacientes.
Ojo
Microfilarias de O vólvulo puede ser detectada en la córnea o en la cámara anterior del ojo mediante examen con lámpara de hendidura.
La detección de microfilarias en la sangre
Como se mencionó, las microfilarias de todas las especies que causan filariasis linfática y las microfilarias de Loa L, M ozzardi y M perstans se detectan en la sangre. (Ver la imagen de abajo.)
Filariasis. Microfilarias de perstans Mansonella en sangre periférica.
Pinchazo en el dedo o sangre venosa capilar se utiliza para gota gruesa. La sangre venosa también se puede concentrar o pasa a través de un filtro Nuclepore antes de ser examinado microscópicamente. Las especies de infección a continuación, se pueden determinar por el aspecto microscópico. W bancrofti y Brugia especies tienen una vaina acelular. W bancrofti no tiene núcleos en la cola, mientras que B malayi tiene núcleos terminal y subterminal. (Ver la imagen de abajo.)
Filariasis. Apariencia de microfilarias después de la concentración de sangre venosa con un filtro Nuclepore.
Microfilarias puede aparecer periódicamente en la circulación periférica. Para la mejor oportunidad de la detección, la sangre debe ser examinado en diferentes intervalos durante un periodo de 24 horas. (Ver la imagen de abajo.)
Filariasis. Microfilaria de Wuchereria bancrofti en un frotis de sangre periférica.
Bancroft y filariasis por Brugia tienden a mostrar periodicidad nocturna, por lo que se recomienda que las muestras se recogieron 22:00-2:00 am. Provocación de microfilarias nocturnally periódica se puede lograr con una dosis día de diciembre a 1-2 mg / kg.
Microfilarias puede estar ausente en los siguientes casos:
- Los pacientes con ADL o enfermedad linfática crónica tardía
- Por lo general, los pacientes con loiasis, a menos que la infección ha estado presente durante muchos años
Conteo sanguíneo completo: La eosinofilia se marca en todas las formas de infección filarial patente.
Concentraciones de inmunoglobulinas séricas: IgE sérica elevada e IgG4 se pueden observar con filariasis activo. Pruebas basadas en la reacción en cadena de polimerasa se ha descrito [34]. Un ensayo de bolas múltiplex en serie para controlar los niveles de anticuerpos en el suero durante el tratamiento se ha propuesto. [35]
La detección de antígeno de filaria
La presencia de antígeno circulante de filarias en la sangre periférica, con o sin microfilarias, se considera diagnóstico de la infección por filarias patente y también se utiliza para controlar la eficacia de la terapia. Los kits comerciales están disponibles para poner a prueba la sangre venosa y pueden ser cuantitativos (inmunoensayo ligado a enzimas [ELISA]) Og4C3 monoclonal de ensayo basado en anticuerpos) o cualitativos (inmunocromatográfico).
El ELISA es uno de los mejores predictores de la carga de gusanos [36], y el otro, aunque no es tan sensible, [37] que una vez fue considerada la prueba de elección en los estudios de campo. Sin embargo, los resultados de esta prueba siguen siendo positivas durante 3 años después del tratamiento, por lo tanto, las pruebas de inmunocromatografía ha demostrado ser ineficaz [38].
La detección de anticuerpos filarias
El uso de antígenos recombinantes para el diagnóstico de la oncocercosis anticuerpos IgG4 (que son un marcador de la infección activa) ha mejorado la sensibilidad y la especificidad de los ensayos serológicos. [39] El habitual IgG e IgE carecen de especificidad (la diferenciación de especies) y por lo general reacción cruzada con antígenos de Strongyloides. Además, ellos no distinguen entre infecciones pasadas y recientes. Por lo tanto, el diagnóstico basado en antígenos recombinantes es útil en expatriados pero no en personas que viven en regiones endémicas.
Estudios de imagen
Los siguientes estudios de imagen se pueden utilizar en la evaluación de la filariasis:
Radiografía de tórax - Infiltrados pulmonares difusos son visibles en los pacientes con eosinofilia pulmonar tropical (TPE)
Ecografía - Puede ser utilizado para demostrar y supervisar la obstrucción linfática de los ganglios linfáticos inguinales y el escroto.
La ecografía también se ha utilizado para demostrar la presencia de gusanos viables, que se ven a estar en movimiento continuo (es decir, signo "filaria danza"). Esta característica de formación de imágenes se ha utilizado para controlar la eficacia del tratamiento. [40] Además, onchocercomas profundas y los cambios en el vítreo del ojo a veces pueden ser detectados con la ecografía.
Linfogammagrafía [3]
Biopsia
Se recomienda que se obtuvieron las muestras de biopsia sólo en pacientes con filariasis cutánea, como la escisión de los nodos puede impedir aún más el drenaje linfático en los pacientes con filariasis linfática. Los gusanos adultos de O vólvulo y L loa se encuentran en los nódulos y el tejido fibrótico de la piel. L gusanos loa vez en cuando pueden ser diseccionados de la conjuntiva del ojo o el puente de la nariz a medida que migran a través del tejido subcutáneo.
Hallazgos histológicos
Filariasis linfática: Los ganglios linfáticos afectados demuestran la fibrosis y obstrucción linfática con la creación de canales colaterales. La piel de los individuos con elefantiasis se caracteriza por hiperqueratosis, acantosis, linfático y tejido graso, la pérdida de las fibras de elastina, y la fibrosis. (Ver la imagen de abajo.)
Filariasis. Los gusanos adultos de Wuchereria bancrofti en sección transversal aisladas de un tumor testicular.
Oncocercosis
Dos áreas son evidentes en onchocercomas: (1) una región central del estroma y granulomatosa, inflamatoria, donde se encuentran los gusanos adultos y (2) una sección periférica, fibrosa. Microfilarias en la piel incitar una reacción inflamatoria de bajo grado, con pérdida de elasticidad y cicatrices fibróticas. (Ver la imagen de abajo.)
Filariasis. Adulto Onchocerca volvulus contenida dentro de onchocercomas de la piel.
Las microfilarias se puede detectar a través del examen de los siguientes:
Sangre - Las microfilarias de todas las especies que causan filariasis linfática y las microfilarias de Loa loa, Mansonella ozzardi y M perstans se detectan en la sangre [2]
Orina - Si se sospecha de la filariasis linfática, la orina se debe examinar macroscópicamente la quiluria y después se concentró para examinar de microfilarias
Piel-Onchocerca volvulus y M infecciones streptocerca son diagnosticados cuando microfilarias se detectan en múltiples muestras de piel-snip de los diferentes sitios situados a ambos lados del cuerpo; la prueba de Mazzotti permite un diagnóstico presuntivo de la filariasis cutánea que deberá efectuarse cuando muestras de piel son negativas para microfilarias
Ojos - Microfilarias de O vólvulo puede ser detectado en la cámara de córnea o anterior del ojo mediante examen con lámpara de hendidura
Tratamiento
Tratamiento
Existen fármacos muy eficaces contra la enfermedad, como son la dietilcarbamazina y la ivermectina. Se considera una enfermedad que podría erradicarse mediante las políticas adecuadas, dirigidas a controlar y eliminar la enfermedad en los seres humanos, con la combinación de medicamentos usados en grandes poblaciones y luchando contra el vector.
Administración
Antihelmínticos utilizados en el tratamiento de la filariasis incluyen los siguientes:
- Dietilcarbamazina (DEC)
- Ivermectina - fármaco de elección para Wuchereria bancrofti
- Suramin - Sólo las drogas de uso clínico para la oncocercosis que es eficaz contra los gusanos adultos
- Mebendazol
- Flubendazol
- Albendazole
- Cirugía
En la filariasis linfática, grandes hidroceles y la elefantiasis escrotal pueden ser manejados con resección quirúrgica. Corrección de elefantiasis bruto extremidad con la cirugía es menos exitosa y puede requerir múltiples procedimientos e injertos de piel.
En la oncocercosis, nodulectomía con anestésico local es un tratamiento común para reducir la piel y las complicaciones oculares.
El tratamiento médico de una infección por filaria debe ser específico y sobre la base de aislamiento de las microfilarias ó antígenos detectados.
La administración masiva de medicamentos reduce la transmisión de la infección por filarias y morbilidad de las enfermedades por la disminución de la carga de la microfilaremia, lo que resulta en niveles subóptimos para la transmisión por vectores de la enfermedad. [41, 42, 43, 44, 45, 46]
Por ejemplo, el tratamiento anual masivo con albendazol e ivermectina se utiliza para interrumpir la transmisión de W. bancrofti. Dado que esta especie no tiene hospederos alternativos, este enfoque podría teóricamente resultar en la eventual erradicación de la filariasis por W. Bancrofti.
Un estudio evaluó el efecto de la dosis más alta y una mayor frecuencia (dos veces al año) del tratamiento con ivermectina-albendazol para W bancrofti y encontró que resultó en el aclaramiento microfilarial completa, así como un espacio más sostenida que la resultante de la dosis estándar de albendazol-ivermectina tratamiento. [47]
Según informes, los efectos del tratamiento masivo de filariasis , se ha mantenido durante un máximo de 6 años[48, 49, 50, 51]. Actualmente no existe una vacuna para filariasis dpero los esfuerzos para desarrollar un tratamiento efectivo están en marcha. [52]
Cirugía en la filariasis
La filariasis linfática: Grandes hidrocele y elefantiasis escrotal pueden ser manejados con resección quirúrgica. Corrección de elefantiasis bruto extremidad con la cirugía es menos exitosa y puede requerir múltiples procedimientos e injertos de piel.
Oncocercosis: Nodulectomía con anestésico local es un tratamiento común para reducir la piel y las complicaciones oculares.
Los pacientes con microfilaremia asintomática en la filariasis linfática pueden ser tratados en forma ambulatoria. Se recomienda la supervisión de la terapia oral de DEC y provocación con la observación posadministración para el cumplimiento del paciente con la terapia y para la gestión de reacciones febriles en pacientes gravemente infectados. La atención hospitalaria al principio puede ser necesario para adenolymphangitis (ADL) y la filariasis crónica.
La administración masiva de medicamentos en la filariasis reduce la transmisión de la infección por filarias y morbilidad de las enfermedades por la disminución de la carga de la microfilaremia, lo que resulta en niveles subóptimos para la transmisión por vectores de la enfermedad. [41]
Antihelmínticos
Agentes antihelmínticos incluyen derivados de lactonas macrocíclicas de avermectina, derivados de piperazina, y derivados de bencimidazol.
Los caminos bioquímicos de parásitos difieren de las de su huésped humano. Por lo tanto, la toxicidad de los agentes antihelmínticos puede ser dirigido en el parásito o sus huevos o larvas. Las acciones de estos fármacos antiparasitarios varían, ya que incluyen lo siguiente:
- La inhibición de los microtúbulos, causando bloque irreversible de la captación de glucosa
- Inhibición de la polimerización de tubulina
- La despolarización del bloqueo neuromuscular
- Inhibición de la colinesterasa
- El aumento de permeabilidad de la membrana celular, lo que resulta en la pérdida de calcio intracelular
- Vacuolización del tegumento schistosome
- El aumento de permeabilidad de la membrana celular a los iones cloruro a través de la alteración de los canales de cloruro
La ivermectina (Mectizan): Es un potente y microfilaricida macrofilaricida para W bancrofti en dosis múltiples. Se utiliza solo o en combinación con diciembre Es el fármaco de elección para el tratamiento de la filariasis de Bancrofti.
La ivermectina ejerce su acción antiparasitaria al actuar como un potente agonista de ácido gamma-aminobutírico (GABA) y los receptores de potenciar las señales inhibidoras enviados a las neuronas motoras, la consiguiente paralización del parásito. Debido a GABA se limita a los seres humanos en el SNC y la ivermectina no atraviesa la barrera de sangre-cerebro, el fármaco no tiene ninguna acción paralítica en los seres humanos.
Dietilcarbamazina (DEC) (HDEC): Es un microfilaricida. Su mecanismo exacto de acción no se entiende, pero se ha demostrado que induce la inmovilización de microfilarias mediante el uso de efectos de hiperpolarización para disminuir la actividad muscular. La alteración de la membrana de la superficie también se produce, con una mejora de la destrucción por el sistema inmune del huésped. Existe evidencia de que declinación pueden mejorar la adhesión de los granulocitos a través de mecanismos dependientes de anticuerpos y-independiente. Las hipótesis incluyen interferencia con el procesamiento intracelular microfilarial y transporte de macromoléculas específicas de diciembre
La administración concomitante de corticosteroides se debe considerar el tratamiento con DEC para minimizar las manifestaciones alérgicas secundarias a la desintegración de las microfilarias, particularmente en O vólvulo y L infecciones loa.
Suramin: Suramin es un antitripanosoma y antihelmíntico. Actualmente, es el único fármaco de uso clínico para la oncocercosis que es eficaz contra los gusanos adultos, pero su uso está limitado por su toxicidad intrínseca y la frecuencia con que se producen las complicaciones asociadas. La OMS ha recomendado que sólo se puede considerar para el tratamiento curativo de las personas en las áreas sin transmisión de la oncocercosis en las personas que salen de un área endémica, y en individuos con oncodermatitis hiperreactiva grave si sus síntomas no son controlados adecuadamente con ivermectina.
La OMS también ha recomendado que suramina no se utiliza para tratar la oncocercosis en las personas de edad avanzada o enfermos, en los pacientes con enfermedad renal o hepática grave, en niños menores de 10 años, en personas con ceguera total (a menos que requieran alivio de lesiones que pican intensamente ), en la ligera a moderadamente personas infectadas que no presentan síntomas y cuyos ojos no están en riesgo, o en mujeres embarazadas (que debe ser tratado después de la entrega).
Mebendazol: causa la muerte del gusano por absorción selectiva y el bloqueo irreversible de la glucosa y otros nutrientes en el intestino adultos susceptibles que habitan helmintos.
Albendazole: Antihelmíntico de amplio espectro. Se disminuye la producción de trifosfato de adenosina (ATP) en los gusanos, causando el agotamiento de la energía, la inmovilización, y, finalmente, la muerte.
Antibióticos
Estos agentes pueden proporcionar una alternativa a los antihelmínticos.
Doxiciclina (Doxy 100, Vibramycin, Doryx, Monodox, Alodox):La doxiciclina es un amplio espectro, derivado sintéticamente, antibiótico bacteriostático en la clase de las tetraciclinas. Este agente se absorbe casi por completo, se concentra en la bilis, y se excreta en la orina y las heces como metabolito biológicamente activo en altas concentraciones.
La doxiciclina inhibe la síntesis de proteínas y, por lo tanto, el crecimiento bacteriano mediante la unión a 30S y posiblemente subunidades ribosomales 50S de las bacterias susceptibles. Se puede bloquear la disociación del peptidil ARN de transferencia (ARNt) de los ribosomas, haciendo la síntesis de proteínas ARN-dependiente de la detención.
Tratamiento farmacológico
La filariasis linfática
Los pacientes con microfilaremia asintomáticos pueden ser tratados en forma ambulatoria. Se recomienda la supervisión de la terapia oral de DEC y la provocación con la observación posadministración para el cumplimiento del paciente con la terapia y para la gestión de reacciones febriles en pacientes gravemente infectados. [23]
La atención hospitalaria al principio puede ser necesario para adenolymphangitis (ADL) y la filariasis crónica. Los servicios abarcan el uso de antihistamínicos, esteroides, alivio del dolor y antibióticos por vía intravenosa para infecciones secundarias.
Linfedema: Los esteroides se pueden utilizar para ablandar y reducir la hinchazón de los tejidos linfedematosos. Leve a moderada filaria linfedema se ha demostrado que mejora con un curso de 6 semanas de doxiciclina, independiente de la infección en curso. [53]
El reposo en cama, elevación de la extremidad y vendajes de compresión se han utilizado tradicionalmente para el tratamiento de linfedema crónico.
Filariasis crónica: El tratamiento de la filariasis crónica no cambia el pronóstico, como la fibrosis irreversible por lo general destruye el tejido linfático. Sin embargo, los pacientes asintomáticos, con la esperanza de disminuir la progresión de la enfermedad, siendo por lo general se someten a tratamiento, aunque el beneficio de esto no está clara. [54]
Quiluria: En el tratamiento de quiluria, una dieta especial baja en grasas y alta en proteínas suplementada con triglicéridos de cadena media puede resultar beneficioso. Además, la acción esclerosante conferida por diagnóstico linfangiografía puede tapar la fuga.
La infección secundaria
La atención de apoyo debe incluir la prevención de la infección secundaria, especialmente en pacientes con enfermedad avanzada. Las personas con infecciones crónicas deben lavar el área afectada con frecuencia, se aplican cremas antisépticas a las abrasiones, mantener sus uñas limpias, usar calzado cómodo, y el ejercicio de la extremidad afectada para ayudar al flujo linfático.
Oncocercosis
Si se utilizan diciembre y suramina (actualmente el único medicamento en el uso clínico de la oncocercosis que es eficaz contra los gusanos adultos), se recomienda la hospitalización para controlar las reacciones y complicaciones del tratamiento. [20]
Moxidectina está siendo investigado como una alternativa a la ivermectina para el tratamiento de la ceguera de los ríos. Este agente puede reducir el número de tratamientos anuales a 6.
Filariasis de Bancrofti
La ivermectina se considera el fármaco de elección para el tratamiento de la filariasis de Bancroft. En los Estados Unidos, que se puede obtener de los Centros para el Control y Prevención de Enfermedades (CDC), en las zonas endémicas del mundo, que se ofrece gratuitamente por el Programa de Donación de Mectizan. La adición de albendazol parece mejorar la respuesta. [55, 56, 57, 58]
Seis semanas y 8 semanas de cursos de doxiciclina han comparado favorablemente con ivermectina más albendazol. [59] El tratamiento doxiciclina puede ser más fácilmente disponible y puede ser mejor tolerado por algunos pacientes. También puede ser capaz de prevenir o invertir la patología linfática. [60]
En un estudio, un curso de 3 semanas de doxiciclina seguido de una dosis única de dEC ha demostrado ser microfilaricida. [60]
Los resultados han validado el uso de regímenes de dosis única de ivermectina y albendazol diciembre o para los programas de control y erradicación a gran escala y dirigida a reducir Wuchereria bancrofti microfilarias, antigenemia, y las manifestaciones clínicas. [47, 61, 62, 63, 64]
Infección perstans M
Debido a que M perstans es resistente al tratamiento antiparasitario estándar, la doxiciclina se usa a veces para erradicar la Wolbachia, un endosimbiotico encontrado en la mayoría de especies de filarias. [18, 65]
El tratamiento con doxiciclina típicamente mata o esteriliza al nematodo filaria. En un estudio abierto, aleatorizado, Coulibaly et al reclutó pacientes con infección perstans M de 4 pueblos africanos en Mali. Los pacientes fueron asignados aleatoriamente para recibir 200 mg de doxiciclina por vía oral cada día durante 6 semanas o ningún tratamiento. [66]
A los 12 meses, 97% de los pacientes que recibieron doxiciclina, no tenían niveles detectables en sangre de perstans M, en comparación con el 16% de los pacientes en el grupo que no recibió tratamiento. A los 36 meses, M perstans quedaron suprimidos en el 75% de los pacientes que recibieron doxiciclina. [66]
Tratamiento y profilaxis según la OMS
El régimen recomendado para la farmacoterapia colectiva consiste en la administración conjunta de dos medicamentos en dosis únicas: albendazol (400 mg) más ivermectina (150-200 mcg/kg) en zonas donde la oncocercosis (ceguera de los ríos) también es endémica, o citrato de dietilcarbamazina (6 mg/kg) en zonas donde la oncocercosis no es endémica. Estos medicamentos eliminan las microfilarias del torrente sanguíneo y matan a la mayoría de los gusanos adultos.
Se recomienda que los pacientes con discapacidad crónica (elefantiasis, linfedema o hidrocele) mantengan una higiene rigurosa y tomen las precauciones necesarias para prevenir las infecciones secundarias y la agravación de la enfermedad.
Respuesta de la OMS
La resolución WHA50.29 de la Asamblea de la Salud insta a los Estados Miembros a que eliminen la filariasis linfática como problema de salud pública.
La respuesta de la OMS fue el lanzamiento en el año 2000 del Programa mundial para eliminar la filariasis linfática, cuyo objetivo es eliminar la filariasis linfática como problema de salud pública en 2020.
La estrategia se basa en dos componentes fundamentales:
- la interrupción de la transmisión mediante programas de tratamiento anual a gran escala (la llamada farmacoterapia colectiva) destinados a cubrir a la totalidad de la población en riesgo;
- el alivio del sufrimiento ocasionado por la filariasis linfática mediante la gestión de la morbilidad y la prevención de la discapacidad.
Farmacoterapia colectiva
Para lograr la interrupción de la transmisión, en las regiones endémicas se procede primero al levantamiento de mapas de la enfermedad para saber dónde hay que proceder anualmente a la farmacoterapia colectiva, luego se lleva a cabo en las regiones endémicas con dosis únicas de albendazol más dietilcarbamazina o ivermectina, tratando así a la totalidad de la población en riesgo.
Para interrumpir totalmente la transmisión de la infección es necesario que la farmacoterapia colectiva dure entre 4 y 6 años. En 2010 se había completado el levantamiento de mapas de la enfermedad en 59 países endémicos, y 53 habían iniciado la aplicación de la estrategia de farmacoterapia colectiva. De estos 53 países, 37 ya habían completado cinco o más ciclos de tratamiento al menos en alguna de sus zonas endémicas.
Entre 2000 y 2010 se habían administrado más de 2800 millones de tratamientos a una población de 900 millones de personas de 53 países, lo cual ha reducido considerablemente la transmisión en muchos lugares. Los datos de investigaciones recientes muestran que la transmisión de la filariasis linfática en las poblaciones en riesgo ha disminuido en un 43% desde el inicio del Programa mundial para eliminar la filariasis linfática. El beneficio económico mundial del Programa entre 2000 y 2010 se ha calculado en US$ 24 000 millones, como mínimo.
Gestión de la morbilidad
La gestión de la morbilidad y la prevención de la discapacidad son fundamentales para mejorar la salud pública y deberían integrarse plenamente en los sistemas de salud. El Programa mundial para eliminar la filariasis linfática también se centra en la capacitación de los profesionales sanitarios y de las comunidades para que dispensen una atención y un tratamiento adecuados.
La gravedad clínica del linfedema y de los episodios de inflamación aguda puede mejorarse con medidas simples de higiene, cuidados de la piel, ejercicio y elevación de los miembros afectados. El hidrocele (acumulación de líquido) puede curarse con métodos quirúrgicos.
Monitoreo a largo plazo
La monitorización del paciente después del tratamiento incluye el seguimiento de 12 meses, con un examen de sangre periférica y muestras de piel de microfilarias.
Observar y vigilar los planes terapéuticos orales con diciembre porque el cumplimiento de la terapia es pobre y por lo general incompleta.
Los pacientes con filariasis son, por defecto, en riesgo de otras infecciones parasitarias debido a zonas endémicas de filariasis de Bancroft también son endémicas de otros parásitos. Después del tratamiento, los pacientes deben ser monitorizados para detectar síntomas que son característicos de las infecciones parasitarias.
Dieta y actividad
La dieta y la actividad
Los alimentos grasos están restringidos en individuos con quiluria probada que se asocia con la filariasis linfática.
Se alienta a los individuos con filariasis linfática crónica de movilizar (con el apoyo de un vendaje de compresión) el miembro afectado.
Prevención
Evitar las picaduras de insectos vectores no suele ser viable para los residentes de las zonas endémicas, pero los visitantes de estas regiones deben usar repelentes de insectos y las redes de mosquito. Según ultimo estudio NEJM agosto 2013
Mosquiteros para erradicar la elefantiasis
Mosquiteros para erradicar la elefantiasis
- Un programa muestra una sencilla y barata estrategia contra la enfermedad
- La colocación de mosquiteras debe ir unida a un programa de reparto de terapias
A veces las medidas más caras y complejas no son la clave del éxito sino que en su lugar, algo más sencillo, puede resultar mucho más efectivo ante un problema. Es el caso de la lucha contra la filariasis linfática, más conocida como elefantiasis, una enfermedad que afecta a más de 120 millones de personas, de las que unos 40 han quedado desfiguradas o incapacitadas por la enfermedad.
Sin despreciar el efecto del tratamiento farmacológico desarrollado para esta infección, que ha permitido plantear la esperanza de eliminar globalmente la enfermedad en 2020, existen otras medidas que podrían ser vitales para conseguir este objetivo que, bien por problemas económicos o bien por cuestiones políticas, no alcanza al 80% de la población diana, cifra indispensable para lograr la erradicación.
Por este motivo, las mosquiteras impregnadas de insecticida pueden suponer una pieza clave en esa lucha, ya que la infección humana se produce por la transmisión de unos parásitos denominados filarias a través de mosquitos.
Los mosquitos son el contenedor donde las microfilarias se incuban durante unas dos semanas hasta convertirse en larvas con capacidad infectiva. Cuando el posquito pica a una persona, deposita las larvas en la piel y el parásito viaja por todo el organismo a través de los vasos linfáticos donde se transforman en gusanos adultos. En ese estado pueden vivir de cinco a 10 años y generar miles de larvas que vuelven a pasar a la sangre. Una persona afectada puede infectar a un mosquito tras una picadura.
Aunque la mayoría de las infecciones no generan síntomas, si no se da un tratamiento, el daño crónico que genera en el sistema linfático, los riñones y el sistema inmunitario hace que, con el paso del tiempo, se produzca una importante inflamación de brazos, piernas, escroto, etc. Además de producir deformidad y discapacidad, existe un gran estigmahacia los pacientes.
De ahí que sea esencial una estrategia para su prevención global y mejorar los vacíos que puedan quedar en relación a la administración del tratamiento. Por este motivo, médicos del Instituto de Papua Nueva Guinea y de universidades como la Case Western Reserve en Cleveland (EEUU) o la de Queesland, en Australia, entre otras, han llevado a cabo un trabajo con dos objetivos: valorar la tasa de eficacia del tratamiento farmacológico a lo largo de cinco años en cinco pueblos de Papua Nueva Guinea. El segundo objetivo era conocer cómo impactaba el reparto gratuito de mosquiteras impregnadas de insecticida 10 años después de haber administrado la medicación.
Menos picaduras y a otras horas
Por un lado, lo que comprobaron fue que el tratamiento médico casi eliminó la presencia del parásito en los humanos pero no frenó su transmisión por los mosquitos. Sin embargo, 36 meses después de la colocación de las mosquiteras, se comprobó una espectacular reducción de las picaduras de mosquitos infectados a los habitantes de estos pueblos. De hecho, las tasas cayeron anualmente de 325 a cero. Además, los insecticidas redujeron el tiempo de vida de los insectos a la mitad, lo que evita que vivan lo suficiente como para que el parásito sea capaz de transmitirse a otros seres vivos.
Por un lado, lo que comprobaron fue que el tratamiento médico casi eliminó la presencia del parásito en los humanos pero no frenó su transmisión por los mosquitos. Sin embargo, 36 meses después de la colocación de las mosquiteras, se comprobó una espectacular reducción de las picaduras de mosquitos infectados a los habitantes de estos pueblos. De hecho, las tasas cayeron anualmente de 325 a cero. Además, los insecticidas redujeron el tiempo de vida de los insectos a la mitad, lo que evita que vivan lo suficiente como para que el parásito sea capaz de transmitirse a otros seres vivos.
Un dato curioso que constatan los investigadores en su estudio, publicado por la revista 'The New England Journal of Medicine', fue que la colocación de mosquiteros alteró la conducta de los mosquitos. Las picaduras ya no se producían por la noche, que es cuando los niveles del parásito en la sangre humana son mayores, sino que lo hacían antes, durante la tarde, por lo que ingerían menos parásitos y esto también ayudó a dificultar la transmisión de la infección a otras personas.
"No deberíamos confiar únicamente en la administración de fármacos para eliminar la filariasis linfática. Al combinar las estrategias existentes con el control del vector, seremos más capaces de conseguir el objetivo de la eliminación", explica Lisa J. Reimer, primera autora del trabajo y profesora en la Facultad de Medicina Tropical de Liverpool. "Nuestros resultados claramente demuestran que esta solución barata podría complementar el éxito de los actuales programas de erradicación, ya que además tiene una alta rentabilidad, tanto para la filariasis como para el control de la malaria", concluye.
Interconsultas
Para evitar un tratamiento inadecuado, consulte a un especialista en enfermedades infecciosas en todos los casos de sospecha de filariasis fuera de los países endémicos. Otras consultas posibles incluyen:
- Urólogo
- Oftalmólogo
- Cirujano general
- Cirujano plástico
Pronóstico
El pronóstico en la filariasis es bueno si la infección se reconoce y trata a tiempo. Enfermedades Filarial rara vez son mortales, pero las consecuencias de la infección pueden causar dificultades personales y socioeconómicos significativos para las personas afectadas.
La morbilidad de la filariasis humana se debe principalmente a la reacción del huésped a las microfilarias o el desarrollo de gusanos adultos en diferentes áreas del cuerpo. La OMS ha identificado la filariasis linfática como la segunda causa de discapacidad permanente y de largo plazo en el mundo, después de la lepra.
Educación del paciente
Los pacientes deben aprender a protegerse de los insectos vectores y abstenerse de regímenes de auto-tratamiento, especialmente con dietilcarbamazina (DEC), ya que este medicamento puede provocar meningoencefalopatía.
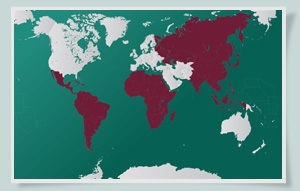
Zonas de riesgo: Filariasis La filariasis es endémica en regiones tropicales de Asia, África, América Central y del Sur. Hay más de 120 millones de personas afectadas en 83 países. Se cree que un 54% de la población de Indonesia tiene microfilarias en su sangre.
Mil millones de personas en riesgo
Por Maria Valero Actualizado por Ángeles López jueves 22/08/2013, Madrid
- 40 millones de personas están gravemente incapacitadas por culpa de este gusano
- Saber cómo son sus genes ayudará a desarrollar terapias eficaces contra él
MADRID.- Se calcula que más de 150 millones de personas en todo el mundo están infectadas con filariasis, una enfermedad causada por un parásito en forma de lombriz, endémico en muchos países tropicales y subtropicales. Un grupo de investigadores estadounidenses, con el apoyo del Instituto Nacional de Salud de EEUU (NIH), ha desvelado por primera vez el genoma de este gusano, capaz de sobrevivir durante años en el interior del organismo humano antes de ocasionar trastornos tan incapacitantes como la elefantiasis.
El equipo de Elodie Ghedin, que trabajaba para el Instituto Craig Venter cuando se realizaron los trabajos, ha desvelado esta semana en las páginas de la revista 'Science' la secuencia genética de'Brugia malayi', uno de estos parásitos alargados (filarias) que amenazan a 1.000 millones de personas en Asia, África y América Latina, según datos de la Organización Mundial de la Salud (OMS).
La filariasis es el tipo más común de elefantiasis y es la primera enfermedad en la que se demostró la transmisión a través de los insectos, allá por 1866. Cuando un mosquito pica a una persona infectada por 'B malayi', el insecto ingiere diminutas larvas del parásito y las vuelve a depositar en la piel de otro humano en una nueva picadura. Estas larvas invaden el sistema linfático, donde son capaces de madurar y reproducirse con facilidad. Se calcula que un ejemplar hembra puede producir mil larvas al día, que crecen hasta alcanzar los siete u ocho centímetros de longitud.
< Imagen del parásito 'Brugia malayi' (Foto: © Science)
Una vez que los parásitos han invadido la linfa, un fluido que recorre todo el interior de nuestro organismo, se produce una obstrucción de los vasos sanguíneos cercanos a los ganglios linfáticos. Como consecuencia, aparecen inflamaciones severas en brazos, piernas, escroto o pene... El tejido infectado aumenta de tamaño, se vuelve tumefacto y la piel se endurece hasta supurar pus.Precisamente estos enormes miembros y la piel tan endurecida como la de un elefante han otorgado a la elefantiasis su particular hueco en el imaginario popular a lo largo de la historia.
Las cifras de la OMS indican que 40 millones de personas en todo el planeta están gravemente incapacitadas a causa de la elefantiasis. Otras 500.000 personas han perdido la vista por la 'ceguera de los ríos' (oncocercosis), otra infección provocada por una variedad distinta de estos parásitos filariales. Otras especies de filarias que también pueden causar estas infecciones son 'Wuchereria bancrofti', 'Onchocerca volvulus' o 'Brugia timori'.
Fallos de las terapias actuales
"Estas infecciones disponen de tratamientos, pero estos fueron descubiertos hace décadas", ha declarado el director del Instituto de Alergia y Enfermedades Infecciosas de EEUU, Anthony Fauci. "Por eso existe una urgente necesidad de avanzar en este terreno y superar los problemas que tienen las actuales terapias, incluidos sus efectos tóxicos y la aparición de resistencias".
Una de estas pegas es que las terapias únicamente atacan a las larvas, no al gusano adulto, que puede llegar a sobrevivir más de 10 años alojado en el cuerpo humano. Precisamente esta longevidad intriga desde hace tiempo a los investigadores, ya que estos 'extraños' sobreviven largos períodos de tiempo sin dar ningún síntoma a quien lo padece, a la sombra del sistema inmunológico, que es incapaz de detectarlos.
Por este motivo, Fauci destaca que la secuenciación del 'Brugia malayi' ha revelado decenas de potenciales dianas que podrían ayudar al desarrollo de nuevos fármacos y vacunas contra la elefantiasis. Una idea en la que ha coincidido la principal investigadora del estudio: "Conocer el patrón genético de este parásito nos permite entender mejor qué genes son importantes en la infección y saber cómo atacarlos".
- Knopp S, Steinmann P, Hatz C, Keiser J, Utzinger J. Nematode infections: filariases. Infect Dis Clin North Am. Jun 2012;26(2):359-81. [Medline].
- Rosenblatt JE. Laboratory diagnosis of infections due to blood and tissue parasites. Clin Infect Dis. Oct 1 2009;49(7):1103-8. [Medline].
- Subramanyam P, Palaniswamy SS. Lymphoscintigraphy in unilateral lower limb and scrotal lymphedema caused by filariasis. Am J Trop Med Hyg. Dec 2012;87(6):963-4. [Medline]. [Full Text].
- Marcos LA, Arrospide N, Recuenco S, Cabezas C, Weil GJ, Fischer PU. Genetic characterization of atypical Mansonella (Mansonella) ozzardi microfilariae in human blood samples from northeastern Peru.Am J Trop Med Hyg. Sep 2012;87(3):491-4. [Medline]. [Full Text].
- [Guideline] World Health Organization. Lymphatic filariasis: the disease and its control. Fifth report of the WHO Expert Committee on Filariasis. World Health Organ Tech Rep Ser. 1992;821:1-71. [Medline].
- Babu BV, Swain BK, Rath K. Impact of chronic lymphatic filariasis on quantity and quality of productive work among weavers in an endemic village from India. Trop Med Int Health. May 2006;11(5):712-7.[Medline].
- Ramaiah KD, Das PK, Michael E, Guyatt H. The economic burden of lymphatic filariasis in India. Parasitol Today. Jun 2000;16(6):251-3. [Medline].
- Witt C, Ottesen EA. Lymphatic filariasis: an infection of childhood. Trop Med Int Health. Aug 2001;6(8):582-606. [Medline].
- Wammes LJ, Hamid F, Wiria AE, Wibowo H, Sartono E, Maizels RM, et al. Regulatory T cells in human lymphatic filariasis: stronger functional activity in microfilaremics. PLoS Negl Trop Dis. 2012;6(5):e1655.[Medline]. [Full Text].
- Baird JB, Charles JL, Streit TG, Roberts JM, Addiss DG, Lammie PJ. Reactivity to bacterial, fungal, and parasite antigens in patients with lymphedema and elephantiasis. Am J Trop Med Hyg. Feb 2002;66(2):163-9. [Medline].
- King CL. Transmission intensity and human immune responses to lymphatic filariasis. Parasite Immunol. Jul 2001;23(7):363-71. [Medline].
- Lamb TJ, Le Goff L, Kurniawan A, Guiliano DB, Fenn K, Blaxter ML, et al. Most of the response elicited against Wolbachia surface protein in filarial nematode infection is due to the infective larval stage. J Infect Dis. Jan 1 2004;189(1):120-7. [Medline].
- Lammie PJ, Cuenco KT, Punkosdy GA. The pathogenesis of filarial lymphedema: is it the worm or is it the host?. Ann N Y Acad Sci. Dec 2002;979:131-42; discussion 188-96. [Medline].
- Meyrowitsch DW, Simonsen PE, Garred P, Dalgaard M, Magesa SM, Alifrangis M. Association between mannose-binding lectin polymorphisms and Wuchereria bancrofti infection in two communities in North-Eastern Tanzania. Am J Trop Med Hyg. Jan 2010;82(1):115-20. [Medline]. [Full Text].
- Panda AK, Sahoo PK, Kerketta AS, Kar SK, Ravindran B, Satapathy AK. Human lymphatic filariasis: genetic polymorphism of endothelin-1 and tumor necrosis factor receptor II correlates with development of chronic disease. J Infect Dis. Jul 15 2011;204(2):315-22. [Medline].
- Ottesen EA. The Wellcome Trust Lecture. Infection and disease in lymphatic filariasis: an immunological perspective. Parasitology. 1992;104 Suppl:S71-9. [Medline].
- Taylor MJ, Hoerauf A. Wolbachia bacteria of filarial nematodes. Parasitol Today. Nov 1999;15(11):437-42.[Medline].
- Tamarozzi F, Halliday A, Gentil K, Hoerauf A, Pearlman E, Taylor MJ. Onchocerciasis: the role of Wolbachia bacterial endosymbionts in parasite biology, disease pathogenesis, and treatment. Clin Microbiol Rev. Jul 2011;24(3):459-68. [Medline]. [Full Text].
- Zouré HG, Wanji S, Noma M, Amazigo UV, Diggle PJ, Tekle AH, et al. The geographic distribution of Loa loa in Africa: results of large-scale implementation of the Rapid Assessment Procedure for Loiasis (RAPLOA). PLoS Negl Trop Dis. Jun 2011;5(6):e1210. [Medline]. [Full Text].
- Carme B, Boulesteix J, Boutes H, Puruehnce MF. Five cases of encephalitis during treatment of loiasis with diethylcarbamazine. Am J Trop Med Hyg. Jun 1991;44(6):684-90. [Medline].
- Eberhard ML, Sims AC, Bishop HS, Mathison BA, Hoffman RS. Ocular zoonotic onchocerca infection in a resident of Oregon. Am J Trop Med Hyg. Dec 2012;87(6):1073-5. [Medline]. [Full Text].
- Eberhard ML, Ostovar GA, Chundu K, Hobohm D, Feiz-Erfan I, Mathison BA, et al. Zoonotic Onchocerca lupi infection in a 22-month-old child in Arizona: first report in the United States and a review of the literature. Am J Trop Med Hyg. Mar 2013;88(3):601-5. [Medline]. [Full Text].
- Centers for Disease Control and Prevention. Progress toward elimination of lymphatic filariasis--Togo, 2000--2009. MMWR Morb Mortal Wkly Rep. Jul 29 2011;60(29):989-91. [Medline].
- Kazura J. Guerrant R, Walker DH, Weller PF, eds. Tropical Infectious Diseases: Principles, Pathogens and Practice. Vol 2. Philadelphia, PA: Churchill Livingstone; 1999:852.
- Pani SP, Yuvaraj J, Vanamail P, Dhanda V, Michael E, Grenfell BT. Episodic adenolymphangitis and lymphoedema in patients with bancroftian filariasis. Trans R Soc Trop Med Hyg. Jan-Feb 1995;89(1):72-4.[Medline].
- Kaiser C, Rubaale T, Tukesiga E, Kipp W, Kabagambe G, Ojony JO, et al. Association between onchocerciasis and epilepsy in the Itwara hyperendemic focus, West Uganda: controlling for time and intensity of exposure. Am J Trop Med Hyg. Aug 2011;85(2):225-8. [Medline]. [Full Text].
- Okon OE, Iboh CI, Opara KN. Bancroftian filariasis among the Mbembe people of Cross River state, Nigeria. J Vector Borne Dis. Jun 2010;47(2):91-6. [Medline].
- Addiss DG, Louis-Charles J, Roberts J, Leconte F, Wendt JM, Milord MD, et al. Feasibility and effectiveness of basic lymphedema management in Leogane, Haiti, an area endemic for bancroftian filariasis. PLoS Negl Trop Dis. Apr 20 2010;4(4):e668. [Medline]. [Full Text].
- Mathieu E, Dorkenoo A, Otogbe FK, Budge PJ, Sodahlon YK. A laboratory-based surveillance system for Wuchereria bancrofti in Togo: a practical model for resource-poor settings. Am J Trop Med Hyg. Jun 2011;84(6):988-93. [Medline]. [Full Text].
- Uttah EC. Prevalence of endemic Bancroftian filariasis in the high altitude region of south-eastern Nigeria.J Vector Borne Dis. Jun 2011;48(2):78-84. [Medline].
- Molyneux DH. Tropical lymphedemas--control and prevention. N Engl J Med. Mar 29 2012;366(13):1169-71. [Medline].
- Gobbi F, Boussinesq M, Mascarello M, Angheben A, Gobbo M, Rossanese A, et al. Case report: Loiasis with peripheral nerve involvement and spleen lesions. Am J Trop Med Hyg. May 2011;84(5):733-7.[Medline]. [Full Text].
- Garg PK, Bhatt S, Kashyap B, George A, Jain BK. Genital filariasis masquerading as testicular torsio. J Vector Borne Dis. Jun 2011;48(2):119-21. [Medline].
- Mehlotra RK, Gray LR, Blood-Zikursh MJ, Kloos Z, Henry-Halldin CN, Tisch DJ, et al. Molecular-based assay for simultaneous detection of four Plasmodium spp. and Wuchereria bancrofti infections. Am J Trop Med Hyg. Jun 2010;82(6):1030-3. [Medline]. [Full Text].
- Moss DM, Priest JW, Boyd A, Weinkopff T, Kucerova Z, Beach MJ, et al. Multiplex bead assay for serum samples from children in Haiti enrolled in a drug study for the treatment of lymphatic filariasis. Am J Trop Med Hyg. Aug 2011;85(2):229-37. [Medline]. [Full Text].
- Chanteau S, Moulia-Pelat JP, Glaziou P, Nguyen NL, Luquiaud P, Plichart C, et al. Og4C3 circulating antigen: a marker of infection and adult worm burden in Wuchereria bancrofti filariasis. J Infect Dis. Jul 1994;170(1):247-50. [Medline].
- Nguyen NL, Plichart C, Esterre P. Assessment of immunochromatographic test for rapid lymphatic filariasis diagnosis. Parasite. Dec 1999;6(4):355-8. [Medline].
- Schuetz A, Addiss DG, Eberhard ML, Lammie PJ. Evaluation of the whole blood filariasis ICT test for short-term monitoring after antifilarial treatment. Am J Trop Med Hyg. Apr 2000;62(4):502-3. [Medline].
- Lal RB, Ottesen EA. Enhanced diagnostic specificity in human filariasis by IgG4 antibody assessment. J Infect Dis. Nov 1988;158(5):1034-7. [Medline].
- Dreyer G, Noroes J, Amaral F, Nen A, Medeiros Z, Coutinho A, et al. Direct assessment of the adulticidal efficacy of a single dose of ivermectin in bancroftian filariasis. Trans R Soc Trop Med Hyg. Jul-Aug 1995;89(4):441-3. [Medline].
- Ottesen EA. Major progress toward eliminating lymphatic filariasis. N Engl J Med. Dec 5 2002;347(23):1885-6. [Medline].
- Ashton RA, Kyabayinze DJ, Opio T, Auma A, Edwards T, Matwale G, et al. The impact of mass drug administration and long-lasting insecticidal net distribution on Wuchereria bancrofti infection in humans and mosquitoes: an observational study in northern Uganda. Parasit Vectors. Jul 15 2011;4:134. [Medline].[Full Text].
- Drexler N, Washington CH, Lovegrove M, Grady C, Milord MD, Streit T, et al. Secondary mapping of lymphatic filariasis in Haiti-definition of transmission foci in low-prevalence settings. PLoS Negl Trop Dis. 2012;6(10):e1807. [Medline]. [Full Text].
- van den Berg H, Kelly-Hope LA, Lindsay SW. Malaria and lymphatic filariasis: the case for integrated vector management. Lancet Infect Dis. Jan 2013;13(1):89-94. [Medline].
- Arndts K, Deininger S, Specht S, Klarmann U, Mand S, Adjobimey T, et al. Elevated adaptive immune responses are associated with latent infections of Wuchereria bancrofti. PLoS Negl Trop Dis. 2012;6(4):e1611. [Medline]. [Full Text].
- Gass K, Beau de Rochars MV, Boakye D, Bradley M, Fischer PU, Gyapong J, et al. A multicenter evaluation of diagnostic tools to define endpoints for programs to eliminate bancroftian filariasis. PLoS Negl Trop Dis. Jan 2012;6(1):e1479. [Medline]. [Full Text].
- Dembele B, Coulibaly YI, Dolo H, Konate S, Coulibaly SY, Sanogo D, et al. Use of high-dose, twice-yearly albendazole and ivermectin to suppress Wuchereria bancrofti microfilarial levels. Clin Infect Dis. Dec 1 2010;51(11):1229-35. [Medline].
- WHO. Global programme to eliminate lymphatic filariasis. Wkly Epidemiol Rec. Sep 12 2008;83(37):333-41. [Medline].
- Linehan M, Hanson C, Weaver A, Baker M, Kabore A, Zoerhoff KL, et al. Integrated implementation of programs targeting neglected tropical diseases through preventive chemotherapy: proving the feasibility at national scale. Am J Trop Med Hyg. Jan 2011;84(1):5-14. [Medline]. [Full Text].
- Tisch DJ, Alexander ND, Kiniboro B, Dagoro H, Siba PM, Bockarie MJ, et al. Reduction in acute filariasis morbidity during a mass drug administration trial to eliminate lymphatic filariasis in Papua New Guinea.PLoS Negl Trop Dis. Jul 2011;5(7):e1241. [Medline]. [Full Text].
- Karmakar PR, Mitra K, Chatterjee A, Jana PK, Bhattacharya S, Lahiri SK. A study on coverage, compliance and awareness about mass drug administration for elimination of lymphatic filariasis in a district of West Bengal, India. J Vector Borne Dis. Jun 2011;48(2):101-4. [Medline].
- Grieve RB, Wisnewski N, Frank GR, Tripp CA. Vaccine research and development for the prevention of filarial nematode infections. Pharm Biotechnol. 1995;6:737-68. [Medline].
- Mand S, Debrah AY, Klarmann U, Batsa L, Marfo-Debrekyei Y, Kwarteng A, et al. Doxycycline improves filarial lymphedema independent of active filarial infection: a randomized controlled trial. Clin Infect Dis. Sep 2012;55(5):621-30. [Medline]. [Full Text].
- Ottesen EA. Filarial infections. Infect Dis Clin North Am. Sep 1993;7(3):619-33. [Medline].
- Critchley J, Addiss D, Ejere H, Gamble C, Garner P, Gelband H. Albendazole for the control and elimination of lymphatic filariasis: systematic review. Trop Med Int Health. Sep 2005;10(9):818-25.[Medline].
- [Best Evidence] Critchley J, Addiss D, Gamble C, Garner P, Gelband H, Ejere H. Albendazole for lymphatic filariasis. Cochrane Database Syst Rev. Oct 19 2005;CD003753. [Medline].
- Ottesen EA, Ismail MM, Horton J. The role of albendazole in programmes to eliminate lymphatic filariasis.Parasitol Today. Sep 1999;15(9):382-6. [Medline].
- Murdoch ME. Onchodermatitis. Curr Opin Infect Dis. Apr 2010;23(2):124-31. [Medline].
- Debrah AY, Mand S, Specht S, Marfo-Debrekyei Y, Batsa L, Pfarr K, et al. Doxycycline reduces plasma VEGF-C/sVEGFR-3 and improves pathology in lymphatic filariasis. PLoS Pathog. Sep 2006;2(9):e92.[Medline]. [Full Text].
- Mand S, Pfarr K, Sahoo PK, Satapathy AK, Specht S, Klarmann U, et al. Macrofilaricidal activity and amelioration of lymphatic pathology in bancroftian filariasis after 3 weeks of doxycycline followed by single-dose diethylcarbamazine. Am J Trop Med Hyg. Oct 2009;81(4):702-11. [Medline].
- Sanprasert V, Sujariyakul A, Nuchprayoon S. A single dose of doxycycline in combination with diethylcarbamazine for treatment of bancroftian filariasis. Southeast Asian J Trop Med Public Health. Jul 2010;41(4):800-12. [Medline].
- Dunyo SK, Nkrumah FK, Simonsen PE. Single-dose treatment of Wuchereria bancrofti infections with ivermectin and albendazole alone or in combination: evaluation of the potential for control at 12 months after treatment. Trans R Soc Trop Med Hyg. Jul-Aug 2000;94(4):437-43. [Medline].
- Ottesen EA, Vijayasekaran V, Kumaraswami V, Perumal Pillai SV, Sadanandam A, Frederick S, et al. A controlled trial of ivermectin and diethylcarbamazine in lymphatic filariasis. N Engl J Med. Apr 19 1990;322(16):1113-7. [Medline].
- Kazura JW. Higher-dose, more frequent treatment of Wuchereria bancrofti. Clin Infect Dis. Dec 1 2010;51(11):1236-7. [Medline].
- Schiefer A, Schmitz A, Schäberle TF, Specht S, Lämmer C, Johnston KL, et al. Corallopyronin A specifically targets and depletes essential obligate Wolbachia endobacteria from filarial nematodes in vivo.J Infect Dis. Jul 15 2012;206(2):249-57. [Medline]. [Full Text].
- [Best Evidence] Coulibaly YI, Dembele B, Diallo AA, Lipner EM, Doumbia SS, Coulibaly SY, et al. A randomized trial of doxycycline for Mansonella perstans infection. N Engl J Med. Oct 8 2009;361(15):1448-58. [Medline].


















No hay comentarios:
Publicar un comentario