Una revisión orientada a la práctica: El diangóstico y las estrategias de abordaje de una patología frecuente que requiere decisiones fundadas en la mejor evidencia disponible.
BMJ 2014; 348 doi: http://dx.doi.org/10.1136/bmj.g2928
Esta revisión explora la epidemiología y las causas del neumotórax y discute las estrategias de gestión basadas en el diagnóstico, las pruebas y los posibles desarrollos futuros.
Puntos principales
|
Fuentes y criterios de selección
Se realizaron búsquedas en la base de datos Cochrane de revisiones sistemáticas de artículos relacionados con el neumotórax. Se hicieron búsquedas en Medline utilizando el término de búsqueda "pneumothorax" que aparece en los tipos pertinentes de estudio (ensayos clínicos, revisiones de literatura, y meta-análisis), así como en las actas de congresos recientes.
Hemos limitado los estudios a los de los adultos. Nos centramos en los ensayos controlados aleatorios, revisiones sistemáticas y meta-análisis, y cuando sea posible, los estudios más recientes. Fueron revisadas las versiones más actualizadas de las directrices pertinentes (British Thoracic Society, American College of Chest Physicians), así como información de clinicalevidence.bmj.com y uptodate.com
¿Qué tan común es el neumotórax?
Entre 1991 y 1995 se registraron tasas anuales de consulta para neumotórax en Inglaterra de 24/ 100 000 para los hombres y de 9.8/100 000 para las mujeres, y las tasas de ingreso fueron 16.7/100 000 y 5.8/100 000 respectivamente, de acuerdo a un estudio que analiza tres bases de datos nacionales.1
La incidencia global representa una tasa de un neumotórax al año en una población de práctica general de tamaño medio. En todo el Reino Unido esto equivale a alrededor de 8.000 hospitalizaciones por neumotórax cada año, lo que representa 50 000 días / cama dada una estancia media de algo menos de un semana.2 Estas admisiones solo han estimado los costos de 13,65 m £ para el Servicio Nacional de Salud. Los costos anuales en los Estados Unidos se han estimado en $ 130m.3
¿Cuáles son los tipos de neumotórax?
El neumotórax se clasifica como:
• Primario o espontáneo
• Espontáneo secundario
• Traumático (iatrogénica o por otras causas)
El neumotórax traumático se encuentra fuera del ámbito de competencias de esta revisión y no será discutido.
La distinción entre neumotórax primarios y secundarios se basa en la ausencia o presencia de enfermedad pulmonar clínicamente aparente. Los neumotórax primarios y secundarios son grupos distintos con respecto a la morbilidad, a la mortalidad, a las tasas de la hipoxia en la presentación, y a las recomendaciones para su manejo.4
Aunque el neumotórax primario (NEP) no se asocia con una enfermedad pulmonar conocida, los pacientes más afectados tienen anormalidades pulmonares no reconocidas que pueden predisponer a un neumotórax.
Un pequeño estudio de casos y controles encontró que se identificaron cambios enfisematoides en la tomografía computarizada en el 81 % de los 27 pacientes no fumadores con neumotórax primario en comparación con el 0 % en el grupo de control de 10 voluntarios sanos que no fumaban.5
El neumotórax secundario se asocia con mucha más morbilidad y mortalidad que la NEP, en parte como resultado de la reducción de la reserva cardiopulmonar en pacientes con enfermedad pulmonar preexistente.
El neumotórax a tensión es una complicación potencialmente mortal que requiere de un reconocimiento inmediato y de tratamiento urgente. El neumotórax a tensión es causado por el desarrollo de una fuga valvulada en la pleura visceral, de manera que el aire se escapa de los pulmones durante la inspiración, pero no puede volver a entrar durante la espiración. Este proceso conduce a una creciente presión de aire dentro de la cavidad pleural y a un compromiso hemodinámico debido a la alteración del retorno venoso y a la disminución del gasto cardíaco.
El tratamiento se realiza con alto flujo de oxígeno y descompresión con aguja de emergencia con una cánula insertada en el segundo espacio intercostal en la línea media clavicular. Luego se inserta un drenaje intercostal después de la descompresión. A menudo, el tratamiento de emergencia debe basarse en un diagnóstico clínico de neumotórax a tensión antes de la confirmación radiológica, a causa del compromiso hemodinámico que amenaza la vida.
Las características radiológicas que sugieren un neumotórax a tensión incluyen el cambio de posición cardiomediastinal que se aleja de la parte afectada y, en algunos casos, la inversión del hemidiafragma y ensanchamiento de los espacios intercostales por el aumento de la presión dentro del hemitórax afectado.
¿Cómo se diagnostica el neumotórax?
El neumotórax puede ser asintomático y diagnosticado mediante una radiografía de tórax o su sospecha puede realizarse sobre la base de las características clínicas típicas. Los síntomas más comunes son dolor en el pecho y falta de aire, característicamente con un inicio agudo, aunque estos síntomas pueden ser sutiles o incluso inexistentes.
Los pacientes con neumotórax secundario tienden a tener más síntomas que aquellos con neumotórax primario como consecuencia de la enfermedad pulmonar coexistente.
Los signos clínicos de neumotórax incluyen una reducción de la expansión de los pulmones, una percusión torácica hiper- resonante, y la disminución de los sonidos respiratorios en el lado afectado. La presencia de hipotensión y taquicardia puede indicar un neumotórax a tensión.
En la mayoría de los pacientes el diagnóstico se confirma con una radiografía de tórax inspiratoria estándar. Las radiografías espiratorias de rutina no se recomiendan ya que no mejoran el rendimiento diagnóstico, al contrario de las recomendaciones históricas4
El sello distintivo de un neumotórax en la radiografía es una línea pleural visceral blanca separada de la pleura parietal y de la pared torácica por una colección de aire, lo que resulta en una pérdida de marcas de tejido pulmonar en este espacio.
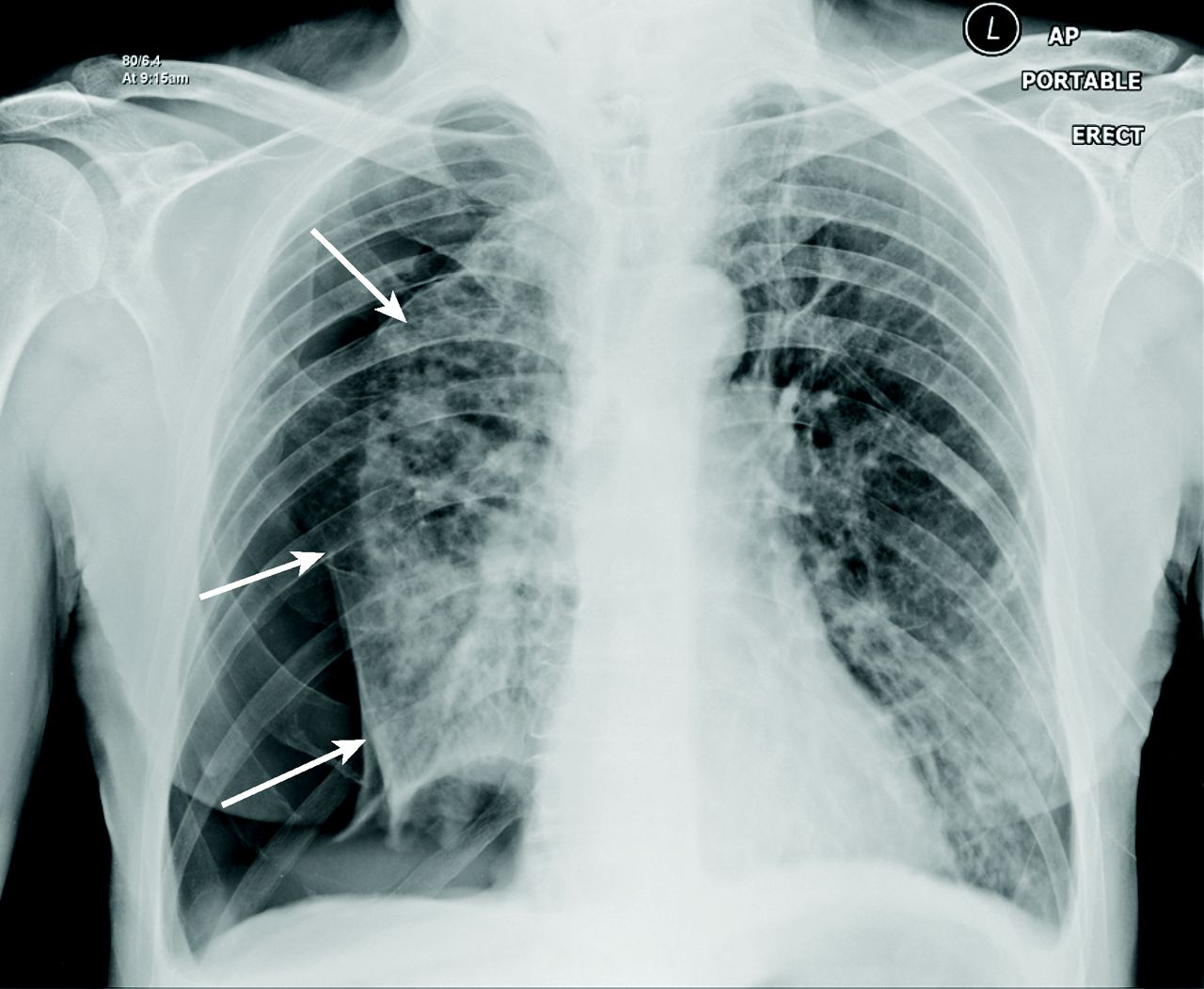
Las características del neumotórax pueden ser más sutiles en las radiografías en decúbito supino, con más aire que se necesita dentro del neumotórax hacer un diagnóstico con confianza. El signo del “surco profundo”, provocado por la acumulación de aire en el surco costofrénico, puede indicar un neumotórax en la radiografía en decúbito supino.
La tomografía computada proporciona una imagen sensible y específica para el neumotórax y es particularmente útil para los procesos de enfermedad complejos, incluyendo neumotórax que se loculados como resultado de las áreas de pulmón adherentes a pleura parietal, así como para facilitar la inserción del drenaje guiado radiológicamente en los casos difíciles.
Además, la tomografía computarizada es útil para distinguir un neumotórax de grandes ampollas (bullas), que puede ocurrir en el enfisema grave y puede imitar la apariencia de neumotórax debido a la ausencia de marcas de tejido pulmonar interior de una bulla.
Por lo general, en las radiografías de tórax bullas se indican con una apariencia cóncava, mientras que un neumotórax es sugerido por una línea pleural visceral que corre paralela a la pared del tórax; sin embargo, esta distinción puede ser hecha claramente con la tomografía computarizada, lo que podría evitar la complicación grave de la inserción de un drenaje en el parénquima pulmonar.
¿Qué predispone a un neumotórax?
Neumotórax espontáneo primario
El factor de riesgo más importante que contribuye al riesgo de neumotórax es el consumo de tabaco. Un estudio retrospectivo de más de 10 años realizado en Estocolmo evaluó los hábitos de fumar de 138 pacientes con NEP y compararon sus tasas de tabaquismo con una muestra aleatoria contemporánea de más de 15 000 personas de la misma área geográfica. Dentro de este estudio, el 88 % de los pacientes con NEP fumaba.
En comparación con los no fumadores , el riesgo relativo de un primer neumotórax se incrementa 9 veces en las mujeres que fuman y por 22 veces en los hombres que fuman.6 Además, este estudio encontró una relación dosis-respuesta notable entre el número de cigarrillos fumados al día y riesgo de neumotórax.6
Fumar Cannabis se asocia con neumotórax, un efecto que puede atribuirse tanto a daño del parénquima por el humo y el más largo aliento –sostenido- o a las maniobras de Valsalva que puede estar asociada con el tabaquismo de cannabis.7
El riesgo de neumotórax primario es mayor en los hombres altos, lo que ha llevado a la hipótesis de que una mayor estiramiento alveolar en el vértice del pulmón en hombres altos contribuye al aumento riesgo.8
El neumotórax en su conjunto tiene una distribución por edades bifásica, con un pico para el neumotórax primario en entre las edades de 15 y 34 años y para el neumotórax secundario entre los mayores de 55 años.1
Neumotórax espontáneo secundario
La enfermedad pulmonar obstructiva crónica es la enfermedad pulmonar más común que causa neumotórax secundario, que representa alrededor del 57 % de casos.9 El riesgo de neumotórax parece aumentar con el empeoramiento de la enfermedad pulmonar obstructiva crónica; alrededor del 30 % de los pacientes con neumotórax secundario tiene un volumen espiratorio forzado en el primer segundo inferior a 1 litro.10
Otras causas de neumotórax secundario incluyen el asma, la neumonía por Pneumocystis Jirovecii relacionada con la infección por el VIH, la fibrosis quística, el cáncer de pulmón, la tuberculosis, enfermedad pulmonar intersticial, y la endometriosis.
La endometriosis torácica parece haber sido una causa poco reconocida de neumotórax. Un estudio prospectivo que evaluó a 32 mujeres con neumotórax referidas para cirugía encontró que el 25 % (n = 8) tenían características que sugerían neumotórax asociado con la menstruación y siete de estas mujeres tuvieron la confirmación histopatológica de endometriosis diafragmática11. Evaluar específicamente a las mujeres por esta posibilidad, puede alterar significativamente la gestión del neoumotórax.
¿Qué predice la recidiva del neumotórax?
Neumotórax espontáneo primario
Dejar de fumar es el factor de riesgo modificable más probado para prevenir la recidiva del neumotórax primario. En un estudio retrospectivo de los pacientes con NEP, incluidos 99 fumadores, el riesgo absoluto de neumotórax recurrente en el período de seguimiento de cuatro años fue de 40% en los que dejaron de fumar en comparación con el 70 % de los que continuaron fumando.12
La recurrencia de NEP también se asocia con un aumento de la altura en hombre12 y se reduce de manera significativa por la cirugía abierta o video cirugía13 torácica asistida.
Neumotórax espontáneo secundario
Los pacientes con enfermedad pulmonar preexistente son más propensos a experimentar un neumotórax recurrente que aquellos con neumotórax primario14 15 En un estudio retrospectivo de 182 pacientes, de los cuales alrededor de la mitad tenían pleurodesis química, las tasas de recidiva al año fueron del 15,8 % para el NEP y 31,2 % para neumotórax secundario15
Las tasas de recurrencia de neumotórax secundario son notablemente más bajas con la cirugía torácica: después de la cirugía torácica vídeo asistida o minitoracotomía axilar, se reportaron tasas de recurrencia de alrededor del 3 % en un estudio con un período de seguimiento medio de 30 meses,13 mientras que otro estudio, con una duración similar de seguimiento, las tasas de recurrencia fueron de 43% en un grupo control de 86 pacientes con neumotórax secundario10.
¿Cuál es el objetivo del manejo del neomotórax?
El objetivo del tratamiento agudo en el neumotórax es excluir un neumotórax a tensión y aliviar cualquier dificultad para respirar. Estos objetivos se reflejan en los diferentes algoritmos de tratamiento en pacientes con neumotórax primario o secundario, los pacientes con este último tipo son más propensos a ser sintomáticos y a presentar compromiso cardiopulmonar asociado, en vista de la enfermedad preexistente. Por el contrario, los pacientes con NEP son a menudo asintomáticos y el neumotórax a tensión es poco frecuente en esta población.
Los primeros estudios que evaluaron el tratamiento del neumotórax se centraron en la resolución radiológica en lugar de los resultados centrados en el paciente, lo que puede haber dado lugar a las directrices que se centraron en la intervención para eliminar el aire del espacio pleural.
Los objetivos del tratamiento del neumotórax son excluir la tensión y reducir la morbilidad temprana y los síntomas asociados con el neumotórax, para limitar la hospitalización cuando sea posible, para reducir el riesgo de recurrencia, y para identificar a los pacientes que se beneficiarían de un procedimiento quirúrgico definitivo.
¿Cuáles son las opciones de tratamiento?
Sorprendentemente para una enfermedad tan común existe una disparidad considerable entre las pautas sociales y la práctica en todo el mundo para el tratamiento del neumotórax. Las opciones de manejo van desde la observación a la aspiración o drenaje o una intervención quirúrgica torácica. La elección está determinada en gran medida por los síntomas y por el grado de compromiso hemodinámico, el tamaño y la causa del neumotórax, si un episodio es el primero o recurrente, y el éxito o fracaso de la gestión inicial.
Existen grandes diferencias entre las directrices relativas a la gestión de neumotórax primarios y secundarios, algunas de los cuales se describen más abajo.3 4
Una diferencia clave entre las directrices es el método para medir el neumotórax : la British Thoracic Society define un neumotórax como “grande” cuando mide > 2 cm desde el margen de pulmón a la pared del tórax a nivel del hilio, mientras que el American College of Chest Physicians define ésto como ≥ 3 cm desde el vértice pulmonar a la cúpula torácica.
Neumotórax espontáneo primario
Suponiendo que la fuga de aire se ha detenido, un neumotórax resolverá gradualmente a medida que el aire se reabsorba en los capilares pulmonares. La tasa de resolución se calculó en el 2,2% por día en un estudio retrospectivo evaluando tres estimaciones dimensionales de tamaño del neumotórax basados en las radiografías de tórax en los pacientes con tratamiento conservador.16 La tasa de reabsorción se cuadruplicó cuando se les administró oxígeno17 por lo tanto alto flujo de oxígeno suplementario está recomendado cuando los pacientes son ingresados para observation.4
Una diferencia clave entre el American College of Chest Physicians y las directrices de la British Thoracic Society es el papel de la aspiración de aire en lugar de la inserción de un drenaje intercostal. Considerando que las directrices británicas recomiendan aspiración en el NEP grande (> 2 cm), la declaración de consenso Americana recomienda la inserción de un drenaje torácico o catéter por un pequeño orificio cuando se requiera una intervención.
Tanto las directrices como la declaración de consenso desalientan el uso de drenajes de gran calibre quirúrgicos en neumotórax sin complicaciones a la vista de la tasa de éxito similar y menores niveles de incomodidad asociados con drenajes con manguera pequeña insertadas con la técnica de Seldinger (en el que se pasa una guía a través de un aguja en el espacio pleural y un drenaje a través del catéter). 3 4
Un ensayo controlado aleatorio de 56 pacientes evaluó la aspiración manual contra la inserción de drenaje intercostal en pacientes con gran neumotórax primario18 y la tasa de recurrencia no difirió entre los grupos. La aspiración manual se asoció a estadías hospitalarias significativamente más cortas, lo que sugiere que esta estrategia es apropiada en este grupo de pacientes.
Una revisión Cochrane anterior, limitada por la inclusión de sólo un ensayo controlado aleatorio, también sugirió que la aspiración no era diferente de la inserción de drenaje torácico en términos de éxito temprano o del éxito a un año, y se asoció con una reducción en el número de pacientes admitidos en el hospital.19
Neumotórax espontáneo secundario
La gestión de neumotórax secundario tiende a involucrar un enfoque más intervencionista a causa del aumento de la morbilidad asociada, de los síntomas y del compromiso cardiorrespiratorio. Es por ello que, ambas guías del Colegio Americano de Médicos del Tórax y la British Thoracic Society, recomiendan la admisión de todos los episodios de neumotórax secundario.3, 4
El oxígeno está indicado, pero cierta cautela puede ser necesaria para los pacientes con riesgo de retención de dióxido de carbono. Aunque la mayoría de los pacientes pueden en última instancia requerir un drenaje intercostal, las directrices británicas recomiendan intentar la aspiración para el neumotórax secundario asintomático que mida 1-2 cm en el hilio, mientras que la declaración de consenso de América sugiere que esto no es apropiado.3 4
La fuga de aire en el neumotórax secundario es menos probable que se establezca de forma espontánea que en el neumotórax primario20 y, los pacientes con neumotórax secundario tienen una duración media de la estancia más larga que aquellos con neumotórax primario : más de 10 días en algunas series.21
La discusión con un cirujano de tórax se aconseja después de 48 horas con una la fuga de aire persistente, ofreciendo un enfoque individualizado para el tratamiento quirúrgico dependiendo de los riesgos de recurrencia y de la morbilidad quirúrgica. Algunos pacientes no son aptos para un procedimiento quirúrgico definitivo y pueden requerir un curso más largo de tratamiento conservador o una estrategia de gestión menos invasiva.
Aspiración
El uso de la succión a través de los drenajes torácicos ha sido empleado en pacientes con pérdida de aire persistente o re-expansión pulmonar incompleta en los que la tasa de fuga de aire desde el pulmón puede ser mayor que la eliminación de aire del espacio pleural a través del drenaje. Esto se utiliza para aumentar el flujo de aire hacia fuera a través del drenaje con la esperanza de que, si la pleura visceral y parietal pueden ser yuxtapuestas a continuación, el defecto en la pleura visceral puede curar más fácilmente.
Un pequeño estudio aleatorio de 23 pacientes no encontró diferencias significativas en los índices de la reexpansión del pulmón y la duración de la estancia hospitalaria entre aspiración y no aspiración. Las directrices de la British Thoracic Society22 recomiendan que la succión no se emplee habitualmente en el tratamiento de neumotórax, pero se puede usar si el pulmón no se vuelve a expandir; una presión de -10 a -20 cm H2O como parte de un sistema de baja presión de alto volumen es el método recomendado4. Este sistema debe minimizar el riesgo de aumento de la fuga de aire y de "robo", un proceso por el cual un gran volumen de cada respiración es arrastrado fuera del tórax a través del drenaje.
La aplicación temprana de aspiración tras el drenaje de un neumotórax se debe evitar debido a un aumento del riesgo de edema pulmonar precipitado por la rápida re-expansión del pulmón colapsado.
Cirugía
La minitoracotomía axilar y la cirugía torácica vídeo asistida son las técnicas más utilizadas para el tratamiento del neumotórax recurrente. Un reciente ensayo controlado aleatorio de 66 pacientes con neumotórax primario o secundario asignados a minitoracotomía o a cirugía torácica vídeo asistida mostró tasas equivalentes de recidiva (2,7% y 3 %, respectivamente) y de dolor postoperatorio13. Comparado con la minitoracotomía, la cirugía torácica vídeo asistida se asoció con mayor satisfacción del paciente (evaluada mediante el uso del brazo ipsilateral después de la operación) y el regreso a la actividad aunque a expensas de un tiempo de procedimiento mayor13.
Pleurodesis
La pleurodesis es un procedimiento que precipita un proceso inflamatorio que conduce a la adherencia de pleura parietal y visceral, borrando de ese modo el espacio pleural. Esto se puede lograr a través de la instilación de un agente tal como el talco o derivados de tetraciclina a través de un drenaje torácico (pleurodesis médica) o por abrasión mecánica de la pleura o la instilación de un agente adecuado durante una operación (pleurodesis quirúrgica). Debido a la naturaleza inflamatoria de la pleurodesis, puede ser dolorosa y requiere de la aplicación de anestesia local en el espacio pleural, así como de una analgesia adecuada.
Un ensayo controlado aleatorio de 214 pacientes con NEP en Taiwán evaluó el efecto de la pleurodesis con minociclina sobre la recurrencia de neumotórax en un año. Todos los pacientes tenían catéteres pigtail para la aspiración de su neumotórax y fueron asignados al azar a la pleurodesis con minociclina o a ninguna pleurodesis. Las tasas de recurrencia fueron significativamente menores (P = 0,003) en el grupo de pleurodesis con minociclina (29,2 %) en comparación con el grupo control (49,1 %).23
Este método de tratamiento, sin embargo, por lo general hizo necesaria una estancia hospitalaria de dos días y la tasa de recurrencia en el grupo control fue mayor que la reportada en otros estudios (33 % al año en un estudio15).
Un estudio aleatorio anterior más pequeño que incluyó participantes con neumotórax primario y secundario comparó el drenaje simple, con tetraciclina o pleurodesis con talco y se encontró que la tasa de recurrencia en un periodo medio de seguimiento de 4,6 años era sólo el 8% en el grupo de pleurodesis con talco, pero del 36% en el grupo con drenaje simple.24
Las directrices de la British Thoracic Society sugieren que la pleurodesis química debe ser considerada sólo en los pacientes con una fuga de aire en curso que no son aptos para la intervención quirúrgica, en lugar de como un tratamiento primario, en vista de las tasas de recurrencia significativamente más bajas (alrededor del 3 %) después de la cirugía.13
¿Qué consejos necesitan los pacientes después de un neumotórax?
Dada la considerable tasa de recurrencia del neumotórax es importante que los pacientes sean informados de los síntomas que pueden indicar la recurrencia y de la necesidad de acudir al médico si esto ocurre.
Las directrices de la British Thoracic Society sugieren que todos los pacientes con neumotórax sean objeto de seguimiento por un médico especialistas en enfermedades respiratorias durante alrededor de 2-4 semanas después del episodio inicial para asegurar la resolución y para identificar y tratar la enfermedad subyacente del pulmón.4
Los pacientes pueden ser advertidos de volver al trabajo y retomar la actividad normal después de la resolución de los síntomas, aunque el esfuerzo extremo y los deportes de contacto deberían retrasarse por más tiempo y hasta la resolución radiológica completa4.
Dejar de fumar reduce de forma significativa la tasa de recurrencia en los pacientes después de un neumotórax primario inicial, con una reducción del riesgo relativo de más del 40%.12 Por lo tanto los pacientes deben ser conscientes de esto y contar siempre con el apoyo necesario para dejar de fumar con éxito. Aparte de la intervención médica, el tabaco es el único factor de riesgo modificable para predecir la recurrencia.
Desafortunadamente, las tasas de abandono del hábito de fumar parecen ser bajas después de neumotórax; más del 80 % de los pacientes en un estudio retrospectivo de 142 pacientes con NEP continuaron fumando un año después de la episodio.25
Buceo
Las directrices de la British Thoracic Society recomiendan que el buceo debe evitarse indefinidamente después de un neumotórax a menos que un procedimiento definitivo como la pleurectomía quirúrgica haya sido realizado.4Esto es debido al riesgo de neumotórax recurrente bajo el agua, la expansión de un neumotórax que puede desarrollarse durante el ascenso con el riesgo de neumotórax a tensión resultante. Para los buceadores profesionales la decisión de ofrecer el tratamiento quirúrgico definitivo después del primer episodio de neumotórax puede permitir la reintroducción segura del buceo.
Viajes en avión
El transporte aéreo no debería aumentar el riesgo de neumotórax, pero las consecuencias de un neumotórax, mientras que se está en el aire son tales que los pacientes no deben viajar en vuelos comerciales con un neumotórax no drenado, y el transporte aéreo debe ser retrasado hasta después de la intervención definitiva o hasta que la resolución haya sido confirmada radiológicamente.26
Las ocasiones en que se presentó un neumotórax recurrente y el grado en que los pacientes toleraban esa recurrencia influirán en la decisión de si el riesgo de los viajes aéreos es aceptable para un individuo. La autoridad de aviación civil del Reino Unido sugiere que es seguro viajar dos semanas después de drenaje exitoso de un neumotórax.
¿Qué nuevos tratamientos se puede esperar?
El tratamiento conservador
Las directrices British Thoracic Society recomiendan que el tratamiento conservador debe ser considerado en pacientes con un neumotórax pequeño (< 2 cm al borde de pulmón a nivel del hilio) que no tienen disnea y reconocen que puede ser apropiada en pacientes con un gran neumotórax y síntomas mínimos.
Un ensayo controlado aleatorio de Australia está actualmente reclutando a pacientes con NEP mayor para comparar el tratamiento conservador (observación luego el alta médica si está clínicamente estable) con respecto al tratamiento estándar (aspiración y drenaje torácico de inserción si no tiene éxito) en la expansión pulmonar a las ocho semanas, así como el efecto en los síntomas, complicaciones y recurrencias.27
La cuantificación de la pérdida de aire
Los sistemas de drenaje torácicos digitales permiten una cuantificación de la pérdida de aire que no es posible con el drenaje bajo agua convencional. Estos sistemas se han estudiado principalmente en pacientes con fuga de aire después de la cirugía torácica, pero pueden permitir la estratificación antes en el neumotórax, distinguiendo aquellos pacientes que son propensos a tener una fuga de aire persistente de aquellos cuya fuga de aire se resolverá con el drenaje continuo con tubo intercostal.
Válvulas endobronquiales
Las válvulas endobronquiales se han utilizado como un medio no - quirúrgicos para lograr una reducción de volumen pulmonar en el enfisema y también se han estudiado como un tratamiento para la pérdida de aire persistente en el neumotórax. Estas válvulas unidireccionales pueden ser insertadas durante una broncoscopia y cuando se colocan en bronquios segmentarios o subsegmentarias permiten el colapso del pulmón distal y la reducción de la fuga de aire al tiempo que permiten el drenaje de las secreciones de las vías aéreas distales.
Las válvulas endobronquiales se han estudiado en 40 pacientes con diferentes causas de fuga de aire en curso, 25 de los cuales tenía un neumotórax espontáneo. Del total, el 93 % (n = 37) tuvieron una reducción o la resolución de la fuga de aire, en el 48 % (n = 19) el logro de una solución completa de la fuga.28 Esta técnica puede permitir un método no quirúrgico de la gestión de los pacientes que no responden al tratamiento convencional, estudios prospectivos pueden ayudar a dilucidar su verdadero papel.
Parche de sangre
El efecto de la inyección intrapleural de sangre autóloga se evaluó en un pequeño ensayo aleatorio controlado de 44 pacientes con enfermedad pulmonar obstructiva crónica avanzada, neumotórax secundario, y una fuga de aire persistente después de siete días de drenaje con tubo intercostal.29
Esta intervención se asoció con una reducción estadísticamente significativa de la pérdida de aire continuo a los 13 días. La fuga de aire se detuvo en un 9% (n = 1) de los que recibieron placebo y en el 73 % (n = 16) de quienes se administró 1-2 ml / kg de sangre, las mayores tasas de éxito se ven entre los que tienen una fuga de aire más pequeña.
Catorce por ciento de los pacientes a los que se les administró la dosis de sangre desarrolló una fiebre de bajo grado que en todos los casos se restableció rápidamente con antibióticos. Este estudio sugiere que esta técnica puede ser útil como una alternativa a la pleurodesis química en pacientes con un riesgo significativo de cirugía.29
Consejos para no especialistas
- El neumotórax se asocia con la aparición repentina de disnea y dolor torácico pleurítico, aunque en algunos pacientes puede ser asintomático.
- El diagnóstico generalmente se puede hacer en las radiografías de tórax, pero a veces se requiere de una tomografía computada.
- El tratamiento depende de si el episodio es un neumotórax primario o secundario.
- La presencia de compromiso hemodinámico puede indicar un neumotórax a tensión, que requiere de una descompresión de urgencia con una cánula a través del segundo espacio intercostal en la línea media clavicular.
- Dejar de fumar reduce el riesgo de recidiva del neumotórax espontáneo primario.
- Después de un neumotórax, el transporte aéreo se debe retrasar hasta después de la intervención definitiva o hasta que la resolución haya sido confirmada radiológicamente - la autoridad de aviación civil del Reino Unido recomienda retrasar el transporte aéreo hasta dos semanas después de la resolución.
Referencias
- Gupta D, Hansell A, Nichols T, Duong T, Ayres JG, Strachan D. Epidemiology of pneumothorax in England. Thorax2000;55:666-71.
- Data from Health & Social Care Information Centre. 2013. www.hscic.gov.uk.
- Baumann MH, Strange C, Heffner JE, Light R, Kirby TJ, Klein J, et al. Management of spontaneous pneumothorax: an American College of Chest Physicians Delphi consensus statement. Chest2001;119:590-602.
- MacDuff A, Arnold A, Harvey J, Group BTSPDG. Management of spontaneous pneumothorax: British Thoracic Society Pleural Disease Guideline 2010. Thorax2010;65(Suppl 2):ii18-31.
- Bense L, Lewander R, Eklund G, Hedenstierna G, Wiman LG. Nonsmoking, non-alpha 1-antitrypsin deficiency-induced emphysema in nonsmokers with healed spontaneous pneumothorax, identified by computed tomography of the lungs. Chest1993;103:433-8.
- Bense L, Eklund G, Wiman LG. Smoking and the increased risk of contracting spontaneous pneumothorax. Chest1987;92:1009-12.
- Feldman AL, Sullivan JT, Passero MA, Lewis DC. Pneumothorax in polysubstance-abusing marijuana and tobacco smokers: three cases. J Subst Abuse1993;5:183-6.
- Withers JN, Fishback ME, Kiehl PV, Hannon JL. Spontaneous pneumothorax: suggested etiology and comparison of treatment methods. Am J Surg1964;108:772-6.
- Chen CH, Liao WC, Liu YH, Chen WC, Hsia TC, Hsu TH, et al. Secondary spontaneous pneumothorax: which associated conditions benefit from pigtail catheter treatment? Am J Emerg Med2012;30:45-50.
- Light RW, O’Hara VS, Moritz TE, McElhinney AJ, Butz R, Haakenson CM, et al. Intrapleural tetracycline for the prevention of recurrent spontaneous pneumothorax. Results of a Department of Veterans Affairs cooperative study. JAMA1990;264:2224-30.
- Alifano M, Roth T, Broet SC, Schussler O, Magdeleinat P, Regnard JF. Catamenial pneumothorax: a prospective study. Chest2003;124:1004-8.
- Sadikot RT, Greene T, Meadows K, Arnold AG. Recurrence of primary spontaneous pneumothorax. Thorax1997;52:805-9.
- Foroulis CN, Anastasiadis K, Charokopos N, Antonitsis P, Halvatzoulis HV, Karapanagiotidis GT, et al. A modified two-port thoracoscopic technique versus axillary minithoracotomy for the treatment of recurrent spontaneous pneumothorax: a prospective randomized study. Surg Endosc2012;26:607-14.
- Lippert HL, Lund O, Blegvad S, Larsen HV. Independent risk factors for cumulative recurrence rate after first spontaneous pneumothorax. Eur Respir J1991;4:324-31.
- Guo Y, Xie C, Rodriguez RM, Light RW. Factors related to recurrence of spontaneous pneumothorax. Respirology2005;10:378-84.
- Kelly AM, Loy J, Tsang AY, Graham CA. Estimating the rate of re-expansion of spontaneous pneumothorax by a formula derived from computed tomography volumetry studies. Emerg Med J2006;23:780-2.
- Northfield TC. Oxygen therapy for spontaneous pneumothorax. BMJ1971;4:86-8.
- Parlak M, Uil SM, van den Berg JWK. A prospective, randomised trial of pneumothorax therapy: manual aspiration versus conventional chest tube drainage. Respir Med2012;106:1600-5.
- Wakai A, O’Sullivan RG, McCabe G. Simple aspiration versus intercostal tube drainage for primary spontaneous pneumothorax in adults. Cochrane Database Syst Rev2007;1:CD004479.
- Chee CB, Abisheganaden J, Yeo JK, Lee P, Huan PY, Poh SC, et al. Persistent air-leak in spontaneous pneumothorax—clinical course and outcome. Respir Med1998;92:757-61.
- Schoenenberger RA, Haefeli WE, Weiss P, Ritz RF. Timing of invasive procedures in therapy for primary and secondary spontaneous pneumothorax. Arch Surg1991;126:764-6.
- So SY, Yu DY. Catheter drainage of spontaneous pneumothorax: suction or no suction, early or late removal? Thorax1982;37:46-8.
- Chen JS, Chan WK, Tsai KT, Hsu HH, Lin CY, Yuan A, et al. Simple aspiration and drainage and intrapleural minocycline pleurodesis versus simple aspiration and drainage for the initial treatment of primary spontaneous pneumothorax: an open-label, parallel-group, prospective, randomised, controlled trial. Lancet2013;381:1277-82.
- Almind M, Lange P, Viskum K. Spontaneous pneumothorax: comparison of simple drainage, talc pleurodesis, and tetracycline pleurodesis. Thorax1989;44:627-30.
- Smit HJ, Chatrou M, Postmus PE. The impact of spontaneous pneumothorax, and its treatment, on the smoking behaviour of young adult smokers. Respir Med1998;92:1132-6.
- Ahmedzai S, Balfour-Lynn IM, Bewick T, Buchdahl R, Coker RK, Cummin AR, et al. Managing passengers with stable respiratory disease planning air travel: British Thoracic Society recommendations. Thorax2011;66(Suppl 1):i1-30.
- Perrin K. Trial ID: ACTRN12611000184976. A randomised controlled trial of conservative versus interventional treatment of primary spontaneous pneumothorax. 2013. www.anzctr.org.au/Trial/Registration/TrialReview.aspx?ID=336270.
- Travaline JM, McKenna RJ Jr, De Giacomo T, Venuta F, Hazelrigg SR, Boomer M, et al. Treatment of persistent pulmonary air leaks using endobronchial valves. Chest2009;136:355-60.
- Cao G, Kang J, Wang F, Wang H. Intrapleural instillation of autologous blood for persistent air leak in spontaneous pneumothorax in patients with advanced chronic obstructive pulmonary disease. Ann Thorac Surg2012;93:1652-7.
- Ho KK, Ong ME, Koh MS, Wong E, Raghuram J. A randomized controlled trial comparing minichest tube and needle aspiration in outpatient management of primary spontaneous pneumothorax. Am J Emerg Med2011;29:1152-7.
- Brims FJ, Maskell NA. Ambulatory treatment in the management of pneumothorax: a systematic review of the literature. Thorax2013;68:664-9.