UCI sin paredes: Una realidad posible
En la administración de unidades de cuidados intensivos (UCI) son necesarios sistemas de trabajo que permitan la detección precoz de enfermos graves en cualquier localización del hospital, pudiendo así actuar en las fases iniciales de la enfermedad, antes de que el deterioro esté establecido.
[REMI-L] REMI 2012;12 (11): A155
En los Servicios de Medicina Intensiva (SMI) atendemos pacientes en situación crítica, esto es, con disfunciones orgánicas o patologías que ponen potencialmente en riesgo su vida. Precisan de monitorización continua, y con frecuencia, tratamiento de soporte funcional de órganos. A pesar de la creencia, hasta hace poco tiempo, de una elevada mortalidad inherente a nuestra especialidad, el porcentaje de pacientes que sobrevive al alta de UCI es en términos globales del 90%. En esta situación, los profesionales debemos seguir trabajando por mejorar nuestros resultados: ser más
-EFICACES: disminuir la mortalidad y la morbilidad;
-EFICIENTES: disminuir la estancia en UCI y la hospitalaria, disminuir el gasto en farmacia y fungible;
- y mejorar la CALIDAD PERCIBIDA por el paciente, por su entorno familiar, y por el equipo sanitario.
Durante años hemos trabajado -y mucho- en mejorar la asistencia del paciente ingresado en la UCI. Aseguramos una buena práctica clínica ajustada a los estándares, y hacemos un esfuerzo por disponer de los mejores dispositivos -en medicación y aparataje- que el desarrollo científico e industrial nos proporcionan.
1. El problema del tiempo
Existe también otra posibilidad de intervención, que los intensivistas siempre hemos integrado como forma propia de actuar, y a la que hemos ido poniendo nombre en distintas patologías: “EL TIEMPO ES VIDA”: léase miocardio, cerebro… A modo de ejemplo, la mortalidad de la sepsis aumenta con el nivel de gravedad: 6,7% en la sepsis, 20,7% en la sepsis grave, y 45,7% en el shock séptico. El retraso en el ingreso en UCI, bien por evaluación inadecuada, bien por falta de camas, da lugar a un aumento de los costes y de la mortalidad. La falta de camas, además, puede afectar a los pacientes ya ingresados en la UCI, cuando en situaciones de presión asistencial se lleva a cabo el alta no programada de un paciente de la Unidad para permitir un ingreso.
Tan arraigado está el concepto de precocidad en los últimos años, que las recomendaciones del European Resuscitation Council para el manejo de la parada cardiorrespiratoria incluyen como primer eslabón de la “cadena de supervivencia”, la instauración de medidas encaminadas a la prevención de la parada cardiaca, mediante la detección de alteraciones fisiopatológicas que ocurren previamente. Y esta es una medida necesaria, ya que, a pesar de una organización estructurada y de calidad en la atención a la PCR, los resultados son desalentadores, con una supervivencia al alta hospitalaria alrededor del 17% según la American Heart Association (AHA), 37% en caso de ritmo inicial desfibrilable, y solo 11% en caso de asistolia o actividad eléctrica sin pulso.
2. Solución: detección precoz
Son necesarios, entonces, sistemas de trabajo que permitan la detección precoz de enfermos graves y potencialmente graves, en cualquier localización del hospital, pudiendo así actuar en las fases iniciales de la enfermedad, antes de que el deterioro esté establecido. Esta actuación puede ser el ingreso directo en UCI, o bien una intervención diagnóstica y/o terapéutica en el lugar en que se encuentra ubicado el paciente (Urgencias, planta…) con un seguimiento estrecho por parte del intensivista y de su médico. Esto parece posible: está demostrado que en las horas previas a producirse un evento grave en un paciente (empeoramiento o incluso PCR) se habían desarrollado ya alteraciones fisiológicas detectables. Estas alteraciones son comunes para cualquier patología inicial, porque reflejan el fracaso de órganos. Son, por ejemplo, cambios en la frecuencia cardiaca, presión arterial, frecuencia respiratoria, oxigenación, ritmo de diuresis o nivel de conciencia. Es decir, que la mayoría de las paradas cardiacas intrahospitalarias no son un evento súbito e impredecible.
3. ¿Quién?
El médico intensivista es el especialista mejor capacitado para esta tarea de detección y atención precoz al enfermo potencialmente grave, ya que nuestra formación es multidisciplinaria, y nuestra práctica clínica habitual incluye la priorización clínica y la gestión de recursos en la toma de decisiones. Por otra parte, no cabe duda que los mejores resultados se obtendrán a partir de la colaboración entre profesionales, por lo que consideramos imprescindible el trabajo en común con el médico responsable del paciente. Y así, la actividad asistencial de los médicos intensivistas paulatinamente ha traspasado las fronteras físicas de las Unidades de Cuidados Intensivos. La puesta en marcha de esta forma de trabajo se beneficia de la formación continuada del personal sanitario implicado: médicos intensivistas y hospitalarios y personal de enfermería. El objetivo es afianzar el concepto de precocidad, y adiestrar sobre la detección de signos de alarma, y las actuaciones iniciales a llevar a cabo. El personal de enfermería juega un papel fundamental ya que pasa más tiempo en contacto con el paciente, y es el encargado de la toma de constantes vitales.
4. ¿Cómo?: Formas de detección. Equipos de respuesta rápida
Existen varios itinerarios para detectar pacientes en situación de riesgo.
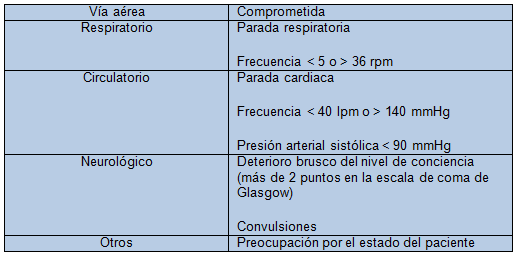
Consiste en la definición de criterios de alarma o gravedad, que desencadenan el aviso al intensivista. Estos criterios suelen ser combinación de valores clínico-analíticos, tales como presión arterial, alteraciones del ritmo cardiaco, hipoxia o alteración de la frecuencia respiratoria, disminución del nivel de conciencia o en el ritmo de diuresis (tabla I).
Inicialmente, cada hospital ha diseñado sus sistemas de alarma, predominando los diseños australianos multiparamétricos, y el modelo inglés con sistemas combinados y ponderados, que generan un tipo de respuesta graduada según la puntuación alcanzada.
Se han descrito hasta 25 criterios de alarma. Esta gran variedad traduce una falta de seguridad en su utilidad, y además, no permite la comparación entre estudios. Efectivamente, el éxito de los Equipos de Emergencias Médicas reside en la identificación correcta de pacientes en riesgo y en el nivel de vigilancia del personal sanitario implicado. Los criterios empleados, por tanto, deben poseer suficiente sensibilidad, ser simples de obtener, sin suponer una sobrecarga de trabajo. Además, la formación continua del personal sanitario es más fácil cuando estos criterios son estables y concisos.
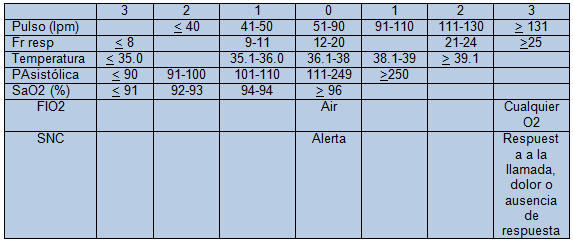
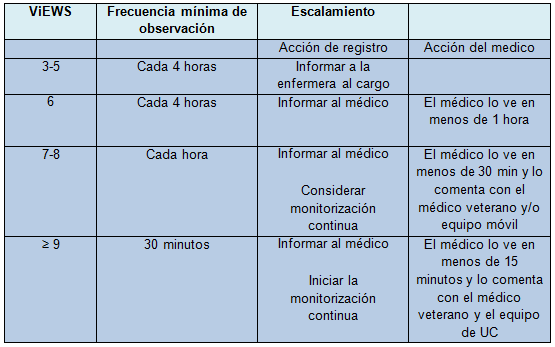
En el año 2010 se publicó un sistema de alarma conocido como ViEWS. Incluye 7 variables clínicas, con diferente puntuación según su alteración. La suma de todos los ítems puede utilizarse para graduar el tipo de respuesta que debe darse en cada situación. (tablas II y III).
Tabla II. ViEWS: VitalPAC Early Warning System [48]
Tabla III. Ejemplo de protocolo progresivo basado en la escala de aviso precoz
En el año 2012 este sistema fue validado externamente en un estudio canadiense, como predictor de mortalidad hospitalaria precoz. También se describió en ese mismo año un sistema ViEWS modificado, que incluía niveles de lactato, y que proporcionaba un mayor valor predictivo positivo para la mortalidad hospitalaria.
4.2. Sistemas a demanda diseñados para patologías concretas
La evolución de diversas patologías ha demostrado ser dependiente de la rapidez con que se instaure el tratamiento: el ictus isquémico, el síndrome coronario agudo, el politraumatismo, la sepsis… En este sentido, existen sistemas específicos de alarma que combinan datos clínico-analíticos, y que proporcionan un árbol de decisión sobre las actuaciones iniciales y la necesidad de aviso a la Unidad de Cuidados Intensivos. El caso más reciente son los programas de atención al paciente séptico, diseñados y difundidos en muchos hospitales tras la iniciativa mundial de la Campaña Sobrevivir a la Sepsis. Diversas publicaciones nacionales e internacionales han demostrado una mayor adherencia a las guías de práctica clínica, y un beneficio en este grupo de pacientes, con descenso en la estancia hospitalaria, e incluso en la mortalidad.
4.3. Detección prospectiva de pacientes en riesgo
Un paso más adelante, consiste en la evaluación de pacientes que, por diferentes motivos, se consideran en riesgo de empeoramiento grave. Este criterio puede ser Al alta de UCI en determinada situaciones, como tras un ingreso prolongado, en situación de fracasos orgánicos en evolución, pacientes quirúrgicos con patología médica grave concomitante…
Pacientes ingresados en áreas hospitalarias consideradas “de riesgo” por ser pacientes en situación aguda, como la Urgencia o las áreas de Observación de Urgencias.
El aspecto a resolver de esta evaluación prospectiva de pacientes previa selección (por ubicación geográfica en el hospital) es, precisamente, la imposibilidad de abarcar el total de pacientes hospitalizados, que debe ser el objetivo final. Gracias a la informatización de la historia clínica, es posible emplear sistemas informáticos que detecten parámetros definidos previamente, como datos de laboratorio, microbiológicos, constantes vitales o notas de enfermería.
El programa puede completarse con el empleo de monitorización de constantes a distancia. Esto sería útil para intensificar el tratamiento y el seguimiento en pacientes que no están en una situación de gravedad como para ingresar en una Unidad de Cuidados Intensivos. Y, otra forma sería la colaboración con otros especialistas, de forma que a diario se establezca una “sesión” bidireccional sobre pacientes a propósito del médico “hospitalario” (internista y/o cirujano como máximo exponente). Consistiría en la valoración conjunta de pacientes que, por su patología, evolución, o antecedentes, preocupan a su médico responsable.
Ya existe una trayectoria de más de 10 años en la bibliografía que muestra los resultados de estrategias encaminadas a la detección y actuación precoz sobre enfermos graves. Son los llamados Sistemas de Respuesta Rápida (SRR), Equipos de Emergencias Médicas (EEM), o Critical Care Outreach (CCO), generalmente liderados por un médico intensivista. Estos equipos tienen como objetivo mejorar los resultados en los pacientes, gracias al reconocimiento e intervención antes de que ocurra un deterioro grave que condicione una parada cardiaca o ingreso urgente en UCI. Es preciso que estén capacitados para evaluar, diagnosticar, iniciar un tratamiento y llevar a cabo el ingreso en UCI en caso de necesidad, por lo que el médico intensivista supone el perfil profesional adecuado.
La atención a pacientes en estadios iniciales de gravedad supone un beneficio en resultados y utilización de recursos. Por este motivo organizaciones sanitarias a diversos niveles recomiendan la creación de estos sistemas. En España, el Ministerio de Sanidad, Servicios Sociales e Igualdad considera el Servicio Ampliado de Cuidados Críticos un estándar de funcionamiento de una Unidad de Cuidados Intensivos. La Consejería de Sanidad de la Comunidad de Madrid los incluyó en su cuarta línea del Plan Estratégico de Seguridad de la Comunidad 2010-2012 para mejorar la atención al paciente crítico. Y, a nivel científico, la SEMICYUC define su existencia como indicador de calidad. El Plan Estratégico de Medicina Intensiva de la Comunidad de Madrid también recomienda su creación.
En las recomendaciones previas y en las guías clínicas siempre se insiste en la importancia de que cada hospital establezca un plan basado en sus necesidades, recursos y organización. Los aspectos fundamentales son la colaboración multidisciplinaria, la formación del personal en el reconocimiento e interpretación correcta de los signos de gravedad, el liderazgo de un médico intensivista, y la implicación de los órganos directivos del centro.
Cada vez es más frecuente la implantación en las UCIs españolas de alguna actividad extraUCI. La SEMICYUC apoya las iniciativas destinadas a este fin, que puede resumirse como la atención al enfermo grave, independientemente del área geográfica del hospital donde esté ubicado. Su objetivo es la detección e intervención precoz, que propiciarán unos mejores resultados finales, con un empleo de recursos más eficiente. En España recogemos experiencias con programas como el Código Sepsis o similares en el Hospital de Valdecilla (Santander), en el Hospital Son LLatzer (Mallorca), o en el Hospital del Henares (Coslada, Madrid), entre otros muchos. En estos y otros centros también se han puesto en marcha Sistemas de Respuesta Rápida para la detección de pacientes graves en todo el ámbito hospitalario, con estructuraciones particulares en cada centro, casi siempre con el soporte informático de la historia clínica electrónica.
Diferentes centros optan por la puesta en marcha de Unidades de Cuidados Intermedios, Unidades de Agudos específicas, Dirección y/o asistencia en los Servicios de Urgencias, como extensión de los Servicios de Medicina Intensiva. También los equipos de Reanimación Cardiopulmonar y la realización de técnicas complementarias, e incluso la colaboración con Atención Primaria, como queda reflejado en el Registro de Actividades de la Especialidad. Cada centro debe estudiar sus necesidades, ofertas y carencias, y diseñar entonces un programa específico, que puede ser diferente del necesario en otro medio. Estos sistemas deben basarse en la colaboración con otros Servicios. Requieren, en ocasiones, de un cambio en el flujo de trabajo habitual, por lo que es de gran utilidad un programa de formación previo para médicos y personal de enfermería de dentro y fuera de las Unidades de Cuidados Intensivos.
Artículos relacionados