Los criterios actualizados( Exhaustiva revisión 2014): Un análisis pormenorizado de los criterios de diagnóstico en cada etapa evolutiva con sus alternativas terapéuticas actualizadas.
Autor(es): Dres. Dunlay SM, Pereira NL, Kushwaha SS
Enlace: Mayo Clin Proc. 2014;89:662-676
Resumen
|
Introducción
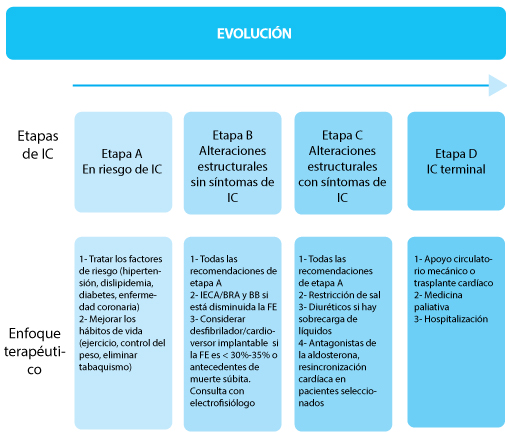
EN 2001, la American College of Cardiology Foundation (ACCF)/American Heart Association (AHA) modificó la clasificación de la insuficiencia cardíaca (IC) para incluir también a los pacientes con alto riesgo de sufrir la enfermedad (etapa A; figura) pero aún no tienen alteraciones cardíacas estructurales ni evidencia clínica de IC. En 2010, Ramani et al analizaron el diagnóstico y el tratamiento actuales de la IC.
Desde entonces se ampliaron las indicaciones para el tratamiento farmacológico y con dispositivos, se produjeron importantes progresos en el apoyo circulatorio mecánico (ACM) y nuevos estudios clínicos para mejorar la asistencia de los pacientes con IC. Este artículo proporcionará una actualización exhaustiva sobre las estrategias diagnósticas y terapéuticas para la IC según su etapa (de A a D), centrándose sobre las nuevas recomendaciones y los resultados de investigaciones que pueden afectar la práctica médica.
IC en etapa A: Pacientes en riesgo
La etapa A de la IC comprende a los pacientes que aún no padecen IC ni alteraciones cardíacas estructurales, pero están en riesgo debido a enfermedad coronaria, diabetes, hipertensión u otros trastornos.
Pronóstico del riesgo de sufrir IC
Aunque sólo los pacientes en etapa C y D reunirían los criterios para IC, el interés por identificar a los pacientes en riesgo de IC (etapa A) hizo surgir varias puntuaciones de riesgo para IC. A partir del estudio Health ABC se creó una puntuación sencilla, basada sobre factores pronósticos independientes de IC (edad, enfermedad coronaria, presión arterial sistólica, tabaquismo, frecuencia cardíaca, glucemia en ayunas, creatininemia, albúmina).
Otro modelo para pronosticar IC validado en las cohortes del estudio ARIC (Atherosclerosis Risk in Communities) incluyó muchas de las mismas variables, así como también raza, sexo, diabetes e índice de masa corporal. Los investigadores hallaron que ambos modelos tenían capacidad pronóstico similar y eran más exactos si se agregaba el péptido natriurético tipo B N-terminal. Ambos modelos de riesgo serían aceptables para emplear en la práctica.
Pruebas genéticas en pacientes con presunta miocardiopatía familiar
El 20%-35% de los pacientes con miocardiopatía dilatada (MCD) pueden padecer miocardiopatía familiar (2 o más familiares cercanos con MCD). Ante un paciente con diagnóstico de MCD se deben obtener todos sus antecedentes familiares. Si los mismos sugieren miocardiopatía familiar es necesario efectuar pruebas genéticas y derivar para consejería genética. Las mutaciones patológicas se identifican sólo en el 30% - 35% de los casos familiares, de modo que los resultados negativos no descartan la posibilidad de una MCD. En los familiares de primer grado no afectados de pacientes con DCM familiar se debe efectuar rastreo con ecocardiografía cada 3 - 5 años.
Tratamiento para corregir los factores de riesgo modificables
En los pacientes identificados como de alto riesgo de IC se deben tratar los factores de riesgo modificables, como la hipertensión, la diabetes, la hiperlipidemia y la obesidad. El tratamiento de la hipertensión puede reducir el riesgo de IC en más del 50% y se debe basar sobre las recomendaciones publicadas, aunque un metanálisis sugirió que los diuréticos, los inhibidores de la enzima convertidora de angiotensina (IECA) y los bloqueantes del receptor de angiotensina son los más eficaces para disminuir el riesgo de IC.
IC en etapa B: Alteraciones cardíacas estructurales, pero sin síntomas clínicos de IC
La IC en etapa B incluye a pacientes con infarto de miocardio previo, remodelado ventricular izquierdo con hipertrofia del ventrículo izquierdo, disminución de la fracción de eyección (FE) y valvulopatía asintomática, que nunca tuvieron síntomas de IC. Se estima que el número de pacientes con IC en etapa B es de 3 a 4 mayor veces que el número de pacientes en etapa C y D asociados. La prevalencia de reducción asintomática de la FE es del 3% - 6% y aumenta con la edad. La disfunción diastólica asintomática es más frecuente, con prevalencia estimada de hasta el 27%.
Los pacientes con IC en etapa B tienen alto riesgo de padecer IC sintomática (etapa C), pero hay estrategias para disminuir ese riesgo. En general, en los pacientes en etapa B se deben emplear todos los tratamientos para la IC en etapa A. Otros tratamientos recomendados se indican en la figura.
La quimioterapia puede causar efectos cardíacos adversos, en especial las antraciclinas (doxorubicina, daunorubicina, epirubicina, idarubicina) y la antraquinona mitoxantrona, con incidencia de hasta el 26%. El riesgo de efectos tóxicos cardíacos aumenta con dosis acumuladas más altas y mayor edad. El empleo de bolos en lugar de infusiones continuas, doxorubicina liposomal vs noliposomal, empleo simultáneo de quelantes del hierro y administración de epirubicina o mitoxantrona (fármacos con menor riesgo de efectos cardíacos) vs doxorubicina pueden contribuir a disminuir el riesgo.
En los pacientes tratados con estos fármacos se debe evaluar la FE al inicio y después periódicamente, con suspensión de la quimioterapia si la FE disminuye en un 10% y es <50%. Todos los pacientes con disminución de la FE deben recibir IECA y β bloqueantes, igual que otros pacientes con IC en etapa B. Otros quimioterápicos que pueden causar IC son la ciclofosfamida, la ifosfamida, el trastuzumab y otros inhibidores monoclonales de la tirosina cinasa basados sobre anticuerpos.
IC en etapa C: Alteraciones cardíacas estructurales y sintomas de IC
Cuando los pacientes tienen signos y síntomas de IC se los clasifica como IC en etapa C, aunque más adelante se transformen en asintomáticos.
La ACCF/AHA publicó recomendaciones generales para el tratamiento de los pacientes con IC. Esta sección se centrará en temas importantes de investigaciones recientes sobre la IC en etapa C.
Biomarcadores para estimar el pronóstico en pacientes con IC
Aunque los biomarcadores se emplean más para diagnosticar IC, también pueden contribuir a estimar el pronóstico en pacientes con IC en etapa C y D. Los péptidos natriuréticos, especialmente el péptido natriurético tipo B o su fragmento amino-terminal (péptido natriurético tipo B N-terminal), que se liberan en respuesta a la distensión miocárdica y las troponinas, liberadas en respuesta a la lesión miocítica, son los biomarcadores más empleados para el pronóstico en la IC.
Un biomarcador surgido recientemente, el ST2, miembro de la familia de receptores de la interleucina 1, pronostica la mortalidad en la IC y puede ayudar a identificar pacientes con IC que se beneficiarían con el ajuste de la dosis de β bloqueantes. La cistatina C es un marcador de lesión renal aguda durante la hospitalización por IC y su aumento de más de 0,3 mg/l en las primeras 48 horas se asocia con mayor duración de la hospitalización y cuatro veces más mortalidad intrahospitalaria.
El valor clínico del tratamiento de la IC orientado por medición serial de los biomarcadores es polémico. El estudio en marcha GUIDE-IT puede aclarar este tema, ya que investiga la eficacia de una estrategia terapéutica orientada por biomarcadores en relación con la atención habitual en pacientes de alto riesgo con disfunción sistólica del ventrículo izquierdo.
Actualización sobre el tratamiento prolongado de pacientes con IC en etapa C
IC con FE conservada. La mitad de los pacientes con IC tienen la FE conservada (ICFEc), lo que habitualmente significa una FE > 40% - 50%. Otras enfermedades asociadas, como anemia, hipertensión y fibrilación auricular, son más frecuentes en pacientes con ICFEc que en los que sufren IC con FE reducida (ICFEr). Al igual que los pacientes con ICFEr, los pacientes con ICFEc tienen más riesgo de muerte (mortalidad a 5 años 50% en ambos grupos). Aún no hay fármacos eficaces para la ICFEc.
Hubo grandes discusiones acerca de la utilidad de los antagonistas del sistema renina-angiotensina para la ICFEc, y los resultados de los diversos estudios son contradictorios. También surgió interés en el empleo de los inhibidores de la fosfodiesterasa 5 para pacientes con ICFEc. Sin embargo, el estudio aleatorizado controlado RELAX no halló cambios en la capacidad de ejercicio o el estado clínico tras 24 semanas de tratamiento con sildenafil en relación con placebo.
Tampoco se mostraron resultados favorables sobre la capacidad de ejercicio en estudios con eplerenona, antagonista de la aldosterona (estudio RAAM-PEF), aunque sí sobre la función diastólica. El estudio TOPCAT no halló reducción del riesgo combinado de mortalidad cardiovascular, paro cardíaco fallido u hospitalización en pacientes con ICFEc tratados con espironolactona en relación con placebo. En la actualidad no hay evidencia suficiente para recomendar el tratamiento sistemático con antagonistas de la aldosterona en pacientes con ICFEc.
Evidencia creciente sugiere que la activación del sistema nervioso simpático es importante en la fisiopatología de la ICFEc. La desnervación renal es un procedimiento que se efectúa a través de un catéter transcutáneo para interrumpir los nervios simpáticos renales. Los primeros estudios en pacientes hipertensos determinaron que es segura y eficaz. El estudio DIASTOLE está investigando si la denervación renal podría ser una opción terapéutica eficaz para pacientes con ICFEc.
Los pacientes con ICFEc deben seguir con tratamiento intensivo de la hipertensión, optimizando el estado de los líquidos con diuréticos, y tratamiento de las enfermedades asociadas, como las alteraciones respiratorias durante el sueño. A pesar de que estos pacientes a menudo sufren disnea de esfuerzo, el ejercicio es seguro para ellos.
Control de la hiperpotasiemia. El control estrecho de la hiperpotasiemia es necesario para los pacientes tratados con antagonistas de la aldosterona. En estudios aleatorizados controlados, la eplerenona y la espironolactona disminuyeron notablemente la muerte y las rehospitalizaciones en pacientes con ICFEr. Como resultado, los antagonistas de la aldosterona recibieron una recomendación clase I en las guías de la ACCF/AHA.
No obstante, no se los adoptó tan rápidamente como a otros tratamientos debido al riesgo de hiperpotasiemia, en especial en pacientes de alto riesgo, como los que reciben antagonistas del sistema renina-angiotensina o los que padecen nefropatía crónica.
Sin embargo, en un estudio de Hernández et al con 5887 pacientes, el 18,2% fueron tratados con estos medicamentos, sin que se hallara diferencia en la mortalidad o en la rehospitalización por todas las causas. Aunque estos pacientes tuvieron menor riesgo de rehospitalización relacionada con su IC, también tuvieron 2,5 veces mayor riesgo de hospitalización por hiperpotasiemia dentro de los 30 días del inicio del tratamiento.
Estos datos, junto con los de estudios aleatorizados controlados indican que los antagonistas de la aldosterona pueden ser eficaces, pero se deben administrar con cautela en pacientes con antecedentes de hiperpotasiemia o insuficiencia renal (filtración glomerular estimada <60 ml/min). La potasiemia y la función renal se deben controlar en todos los pacientes, 1 semana, 4 semanas y 3 meses después de iniciado el tratamiento.
Tratamiento de resincronización cardíaca. El tratamiento de resincronización cardíaca (TRC) se debe considerar en pacientes con síntomas menos graves. En versiones anteriores de las recomendaciones de ACCF/AHA, la indicación clase I para TRC era sólo para pacientes con síntomas funcionales clase III de la New York Heart Association (NYHA), FE del 35% o menos y aQRS de 120 milisegundos o más.
En la actualización de 2012 de ACCF/AHA/Heart Rhythm Society, las indicaciones clase I se ampliaron a los pacientes con síntomas clase II de la NYHA, pero limitadas a pacientes con bloqueo de rama izquierda y QRS de 150 milisegundos o más. Estos cambios se efectuaron sobre la base de trabajos como REVERSE, MADIT-CRT y RAFT.
Tratamiento con hierro intravenoso. El tratamiento con hierro intravenoso mejora la capacidad de ejercicio en pacientes ferropénicos con IC. La anemia se asocia con mayor morbimortalidad entre los pacientes con IC. Debido a que la absorción oral del hierro no es buena, su eficacia y seguridad por vía intravenosa se investigaron en 3 estudios aleatorizados. El tratamiento con hierro intravenoso no tuvo efectos adversos y mejoró la clase funcional de la NYHA y la capacidad para el ejercicio en pacientes ferropénicos con IC con anemia y sin ella. La eritropoyetina se produce en los riñones, suele estar aumentada en pacientes con IC y se asocia con evolución desfavorable.
En pacientes con nefropatía crónica avanzada, la eritropoyetina se usa con frecuencia para tratar la anemia y por eso interesa su empleo en pacientes con IC y anemia. A pesar de resultados prometedores en estudios pequeños, el estudio reciente RED-HF (reducción de episodios con la darbepoyetina alfa en la IC) que aleatorizó a 1136 pacientes con hemoglobina de 9 -12 g/dl a recibir darbepoyetina alfa o placebo, no halló diferencia en la evolución clínica en ambos grupos. No hay hasta ahora datos suficientes para avalar el empleo sistemático de eritropoyetina en pacientes con IC y anemia.
Farmacogenética. La farmacogenética es el estudio de la función de los factores heredados en la respuesta de cada persona a un fármaco. Los adelantos actuales posibilitan la identificación rápida y con exactitud de la secuencia y la estructura del ADN. Como consecuencia, se puede relacionar la variación genómica con la respuesta al fármaco, lo que ayuda a pronosticar la variación individual de las respuestas a medicamentos específicos, a optimizar la elección y la dosis de los medicamentos y a evitar sus efectos adversos.
En la IC, un ejemplo de la posible importancia de la farmacogenética es el empleo de los β bloqueantes. Aunque éstos reducen la morbimortalidad, la respuesta es heterogénea. El subestudio de ADN de la investigación HF-ACTION halló que pacientes con una variante alélica específica del receptor adrenérgico β 1(Arg389) necesitaban dosis mayores de β bloqueantes para lograr efectos similares a los de otros pacientes. Aún quedan importantes desafíos a resolver sobre la implementación de la farmacogenética en la práctica clínica.
Actualizaciones sobre el tratamiento de pacientes con IC aguda descompensada
Unidades de observación en el servicio de urgencias.
Las unidades de observación en el servicio de urgencias (SU) pueden disminuir la necesidad de hospitalización de los pacientes con IC aguda descompensada (ICAD). Sólo una pequeña proporción de los pacientes hospitalizados desde el SU sufren shock cardiogénico o necesitan evaluaciones diagnósticas invasivas o infusiones inotrópicas intravenosas. No obstante, el 80% - 90% de los pacientes que consultan al SU por IC son hospitalizados.
Debido a que algunos de estos pacientes quizás sólo necesitan descongestión y control durante poco tiempo, surgió interés por averiguar si se pueden crear protocolos de observación en el SU para tratar a los pacientes con IC que necesiten más evaluación antes de decidir su hospitalización. Se propuso un algoritmo para identificar a los pacientes de riesgo bajo e intermedio que deben estar en observación.
Los pacientes de alto riesgo – con inestabilidad hemodinámica, función renal que empeora y cifras de troponina altas- serían hospitalizados. Aquéllos que rápidamente vuelven a su estado inicial tras comenzar el tratamiento con diuréticos y no tienen signos de alto riesgo podrían ser dados de alta.
El grupo de riesgo bajo e intermedio sería candidato para una unidad de observación durante 24 horas a fin de monitorear su respuesta al tratamiento. Hasta el 50% de los pacientes que son hospitalizados por IC podría ser candidato para las unidades de observación y hasta el 75% de éstos podría recibir el alta tras la observación.
Estrategias para la descongestión de los pacientes hospitalizados con IC Aproximadamente el 90% de estos pacientes se tratan con diuréticos del asa, pero se discute si los mejores resultados son con la dosis administrada en bolo o en infusión continua. En 2011, el trabajo DOSE-AHF, patrocinado por los National Institutes of Health, no halló ninguna diferencia entre uno y otro método.
Síndrome cardiorrenal. El tratamiento para los pacientes con síndrome cardiorrenal es problemático. Las estrategias recomendadas anteriormente fueron la ultrafiltración, la dopamina en dosis bajas y la nesiritida. Sin embargo, resultados recientes sugirieron que ninguno de estos tratamientos es más eficaz que los diuréticos intravenosos.
El estudio CARRESS-HF halló que la pérdida de peso producida por la ultrafiltración era similar que la de los diuréticos más inotrópicos, pero se asociaba con empeoramiento de la función renal y aumento de los episodios adversos. Los trabajos DAD-HF y ROSE-AHF estudiaron la eficacia del agregado de dopamina en dosis bajas a los diuréticos. En el primero, los pacientes aleatorizados a una dosis baja de furosemida en infusión y 5 mg/kg por minuto de dopamina mejoraron su función renal en relación con pacientes tratados con dosis muy altas de furosemida en infusión (20 mg/h).
En cambio, el estudio ROSE-AHF no halló diferencia en el volumen urinario ni la función renal con el agregado de dopamina a los diuréticos intravenosos en pacientes con ICAD y disfunción renal. La nesiritida, un péptido natriurético tipo B recombinante, se autorizó en los EEUU en 2001 para pacientes con ICAD porque estudios habían hallado mejoría de la disnea y reducción de la presión capilar pulmonar tras su administración. Sin embargo, metanálisis ulteriores indicaron que la nesiritida se puede asociar con empeoramiento de la función renal y mayor mortalidad.
Tanto el estudio ASCEND (sobre episodios cardiovasculares en pacientes diabéticos), como el ROSE-AHF, ambos aleatorizados, no encontraron aumento del riesgo de muerte o empeoramiento de la función renal en pacientes tratados con nesiritida. Ambos estudios hallaron mayor riesgo de hipotensión con nesiritida. No hay evidencia robusta que apoye el empleo sistemático de ultrafiltración, dopamina o nesiritida para el tratamiento de la ICAD y el síndrome cardiorenal. Podría ser más prudente tratar a los pacientes con diuréticos del asa intravenosos y considerar otros métodos sólo para los que son resistentes al tratamiento inicial.
Rehospitalizaciones por IC. Uno de cada 4 pacientes dados de alta tras la hospitalización por IC vuelve a ser hospitalizado dentro de los 30 días. Dadas las consecuencias económicas y sanitarias de las rehospitalizaciones, numerosas instituciones las consideran como un indicador de la calidad de la asistencia médica. A partir de 2012, los centros para los servicios de Medicare y Medicaid comenzaron a multar a los hospitales con tasas mayores que las esperadas de rehospitalización a 30 días por neumonía, infarto agudo de miocardio e IC.
Desde entonces, se implementaron diversas estrategias para disminuir las rehospitalizaciones. Quizás el análisis más esclarecedor de las mejores prácticas sea el de Bradley et al, quienes describieron seis estrategias asociadas con disminución significativa de las rehospitalizaciones en un relevamiento nacional de hospitales:
1. Trabajar junto con los médicos de atención primaria
2. Trabajar junto con los hospitales locales para disminuir las rehospitalizaciones
3. Tener enfermeras que se hagan responsables de la hoja de registro de fármacos que recibe el paciente
4. Arreglar una cita de seguimiento antes del alta
5. Enviar todos los papeles del alta o los resúmenes electrónicos directamente al médico de atención primaria del paciente.
6. Asignar personal encargado del seguimiento de los resultados de las pruebas llegados tras el alta del paciente.
IC en etapa D: IC terminal resistente al tratamiento
La etapa D abarca a los pacientes con IC resistente al tratamiento y a menudo incluye pacientes con repetidas hospitalizaciones. Estos pacientes experimentan síntomas limitantes en su vida cotidiana. Se estima que aproximadamente el 5% de los pacientes con IC están en etapa D. La mortalidad estimada a 1 y 5 años es del 28%y del 80%, respectivamente.
En años recientes, las opciones terapéuticas para los pacientes con IC en etapa D aumentaron. No obstante, no todas las opciones son apropiadas para todos los pacientes y ciertos tratamientos no coinciden con los objetivos y las preferencias de algunos pacientes.
Por lo tanto, se reconoce la necesidad de promover la toma de decisiones conjunta y la mayor comunicación médico-paciente en los pacientes con IC en etapa D. Se debe considerar la interconsulta con un especialista en IC cuando:
- Surjan interrogantes sobre el tratamiento y especialmente cuando los síntomas sean de difícil manejo;
- El paciente no pueda tolerar ciertos medicamentos, como los β bloqueantes;
- Las hospitalizaciones son complicadas o repetidas;
- El médico cree que se deben considerar el ACM y el trasplante cardíaco.
Apoyo circulatorio mecánico
El apoyo circulatorio mecánico es eficaz para determinados pacientes con IC en etapa D. Hasta hace poco, el tratamiento de reemplazo cardíaco se limitaba al trasplante cardíaco ortotópico. Aunque éste es un tratamiento eficaz, el suministro de órganos es limitado.
En las últimas 2 décadas, los dispositivos de ACM se hicieron más pequeños y las tasas de complicaciones disminuyeron. Los dispositivos de asistencia ventricular izquierda (DAVI) empleados más frecuentemente proporcionan flujo continuo desde el ventrículo izquierdo hacia la aorta. Son durables y los pacientes que no son candidatos a un trasplante pudieron recibir el implante de un DAVI que puede permanecer in situ hasta su muerte. Asimismo, permitieron a los pacientes que están esperando un trasplante cardíaco aprovechar las ventajas de la mejoría de los síntomas de IC y de su calidad de vida hasta que se disponga de un órgano apropiado (puente hasta el trasplante).
Como cualquier tratamiento, los dispositivos de ACM tienen riesgos y beneficios. Aunque la supervivencia y la calidad de vida mejoran en pacientes con IC avanzada tratados con ACM en relación con el tratamiento médico (supervivencia a 1 año, 68% vs 25%, respectivamente), las complicaciones son comunes. En pacientes con un DAVI implantado como medio terapéutico permanente, la infección relacionada con el dispositivo y el accidente cerebrovascular aún son muy comunes.
El motivo de rehospitalización más frecuente tras el implante de un DAVI es la hemorragia gastrointestinal y un conjunto creciente de datos implicó a la deficiencia adquirida del factor de von Willebrand con pérdida de grandes multímeros de von Willebrand. Se estima que sólo el 30% de los pacientes que reciben ACM no sufren ningún efecto adverso (infección, hemorragia, mal funcionamiento del dispositivo, accidente cerebrovascular o muerte) durante el primer año de su implante. Además casi todos los pacientes necesitan una o más rehospitalizaciones poco tiempo después del implante.
A medida que la experiencia del tratamiento de pacientes con DAVI aumenta, aprendemos más sobre las estrategias óptimas para el seguimiento. Un componente importante es el monitoreo ecocardiográfico y un conjunto creciente de datos en la literatura médica informa sobre los valores ecocardiográficos normales y anormales tras el implante de un DAVI.
El costo de estos dispositivos sigue siendo alto en relación con otros tratamientos relacionados con dispositivos cardíacos, como los TRC. Alcanzar los mejores resultados exige óptima elección de los pacientes e implante en el momento adecuado de la trayectoria de la IC. Aunque históricamente los DAVI se emplearon para pacientes con miocardiopatía dilatada e isquémica, algunos centros los están implantando en determinados pacientes con miocardiopatía hipertrófica y restrictiva.
La tecnología de ACM continúa evolucionando. Se están creando bombas en miniatura implantables, como la CircuLite Synergy, que pueden proporcionar apoyo parcial prolongado (menos litros por minuto que las DAVI actuales), pero no requiere derivación cardiopulmonar o esternotomía para su implantación.
La HeartMate III de Thoratec Corporation tiene un diseño compacto, pero puede brindar apoyo total (hasta 10l/ min). Ya se está proporcionando apoyo biventricular para algunos pacientes con el corazón artificial total, una bomba que se implanta con la extracción de ambos ventrículos y la mayor parte de ambas aurículas. El Corazón Artificial Total, de Syn- Cardia Systems, Inc, T está autorizado por la US Food and Drug Administration (FDA) como puente para el trasplante desde 2001 y más recientemente como uso por motivos humanitarios como sistema de asistencia definitiva cuando no pueden recibir un trasplante.
Planificación anticipada de la atención médica
Todos los pacientes con IC en etapa D deben participar en la planificación anticipada de su atención médica. La mayor tasa de hospitalizaciones y de empleo de recursos en los pacientes con IC se produce al final de la vida a pesar de que la mayoría de los enfermos crónicos expresan que quisieran evitar la hospitalización cuando están cercanos a la muerte.
En la IC, numerosos modelos pueden pronosticar la muerte y las rehospitalizaciones. El Seattle Heart Failure Model es el más utilizado. Aunque los modelos son imperfectos para pronosticar la evolución individual, en general son más precisos que el criterio clínico. Combinar los modelos pronósticos de riesgo y adaptarlos según la situación del paciente puede ser el mejor enfoque.
Debido a que la trayectoria de la IC a menudo es impredecible, es importante que los médicos revean periódicamente las preferencias de los pacientes para su asistencia en caso de sucesos esperados o no esperados. Las directivas anticipadas, que son un componente importante de la planificación anticipada de la atención médica, y la documentación de los deseos del paciente al respecto deberían constar en la historia clínica y ser repasadas entre el paciente, los médicos y los familiares según necesidad.
Los cuidados paliativos, que tienen el objetivo de mejorar la calidad de vida y apoyar a los pacientes y las familias que enfrentan enfermedades crónicas y complejas, se asocian con mayor satisfacción del paciente y sus familiares y menor empleo de los servicios de salud, así como menores costos. Deben ser una opción para los pacientes con IC en etapa D.
Conclusión
Desde 2010 no hay nuevos tratamientos para la IC, pero se produjeron continuos adelantos en la capacidad de los profesionales para diagnosticar y tratar a los pacientes con IC. En especial las mejoras en curso en el ACM ofrecieron a algunos pacientes con IC terminal nuevas opciones para prolongar la vida. Debido a que la prevalencia de la IC continúa en aumento, es importante seguir buscando maneras efectivas de prevenir la IC activa en pacientes con IC en etapa A y B y de hallar tratamientos eficaces para la creciente cantidad de pacientes con ICFEp.
Desde 2010 no hay nuevos tratamientos para la IC, pero se produjeron continuos adelantos en la capacidad de los profesionales para diagnosticar y tratar a los pacientes con IC. En especial las mejoras en curso en el ACM ofrecieron a algunos pacientes con IC terminal nuevas opciones para prolongar la vida. Debido a que la prevalencia de la IC continúa en aumento, es importante seguir buscando maneras efectivas de prevenir la IC activa en pacientes con IC en etapa A y B y de hallar tratamientos eficaces para la creciente cantidad de pacientes con ICFEp.
Abreviaturas y acrónimos ACCF AHA: American College of Cardiology Foundation/ American Heart Association ACM: apoyo circulatorio mecánico DAVI: dispositivo de asistencia ventricular izquierda FE: fracción de eyección IC: insuficiencia cardíaca ICAD: insuficiencia cardíaca aguda descompensada ICFEc: insuficiencia cardíaca con fracción de eyección conservada ICFEr: insuficiencia cardíaca con fracción de eyección reducida MCD: miocardiopatía dilatada NYHA: New York Heart Association SU: servicio de urgencias TRC: tratamiento de resincronización cardíaca |
Artículos relacionados
> Insuficiencia cardiaca; Lo que no se puede dejar de saber
> Nueva guía 2013 para el manejo de la insuficiencia cardiaca
> Insuficiencia cardiaca aguda en el departamento de Emergencia
> Estimulación biventricular en pacientes con insuficiencia cardiaca > Nueva guía 2013 para el manejo de la insuficiencia cardiaca
> Insuficiencia cardiaca aguda en el departamento de Emergencia
> Guía práctica para insuficiencia cardiaca y edema agudo de pulmón
Traducción y resumen: Dr. Rafael Perez Garcia vía Emergency & Critical Care
Referencias bibliográficas
1. Heidenreich PA, Albert NM, Allen LA, et al; American Heart Association Advocacy Coordinating Committee; Council on Arteriosclerosis, Thrombosis and Vascular Biology; Council on Cardiovascular Radiology and Intervention; Council on Clinical Cardiology; Council on Epidemiology and Prevention; Stroke Council. Forecasting the impact of heart failure in the United States: a policy statement from the American Heart Association. Circ Heart Fail. 2013; 6(3):606-619.
2. Bleumink GS, Knetsch AM, Sturkenboom MC, et al. Quantifying the heart failure epidemic: prevalence, incidence rate, lifetime risk and prognosis of heart failure; the Rotterdam Study. Eur Heart J. 2004; 25(18):1614-1619.
3. Hunt SA, Baker DW, Chin MH, et al. ACC/AHA Guidelines for the Chronic Management of Heart Failure in the Adult: Executive Summary. Circulation. 2001; 104(24):2996-2997.
4. Ramani GV, Uber PA, Mehra MR. Chronic heart failure: contemporary diagnosis and management. Mayo Clin Proc. 2010; 85(2):180-195.
5. Ammar KA, Jacobsen SJ, Mahoney DW, et al. Prevalence and prognostic significance of heart failure stages: application of the American College of Cardiology/American Heart Association heart failure staging criteria in the community. Circulation. 2007; 115(12):1563-1570.
6. Butler J, Kalogeropoulos A, Georgiopoulou V, et al. Incident heart failure prediction in the elderly: the Health ABC heart failure score. Circ Heart Fail. 2008; 1(2):125-133.
7. Agarwal SK, Chambless LE, BallantyneCM, et al. Prediction of incident heart failure in general practice: the Atherosclerosis Risk in Communities (ARIC) Study. Circ Heart Fail. 2012; 5(4):422-429.
8. Yancy CW, Jessup M, Bozkurt B, et al; American College of Cardiology Foundation; American Heart Association Task Force on Practice Guidelines. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2013;62(16): e147-e239.
9. Hershberger RE, Siegfried JD. Update 2011: clinical and genetic issues in familial dilated cardiomyopathy. J Am Coll Cardiol. 2011; 57(16):1641-1649.
10. Hershberger RE, Cowan J, Morales A, Siegfried JD. Progress with genetic cardiomyopathies: screening, counseling, and testing in dilated, hypertrophic, and arrhythmogenic right ventricular dysplasia/cardiomyopathy. Circ Heart Fail. 2009; 2(3):253-261.
11. Beckett NS, Peters R, Fletcher AE, et al; HYVET Study Group. Treatment of hypertension in patients 80 years of age or older. N Engl J Med. 2008; 358(18):1887-1898.
12. Sciarretta S, Palano F, Tocci G, Baldini R, Volpe M. Antihypertensive treatment and development of heart failure in hypertension: a Bayesian network meta-analysis of studies in patients with hypertension and high cardiovascular risk. Arch Intern Med. 2011; 171(5):384-394.
13. Chobanian AV, Bakris GL, Black HR, et al; National Heart, Lung, and Blood Institute Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure; National High Blood Pressure Education Program Coordinating Committee. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure: the JNC 7 report. JAMA. 2003; 289(19):2560-2572.
14. Frigerio M, Oliva F, Turazza FM, Bonow RO. Prevention and management of chronic heart failure in management of asymptomatic patients. Am J Cardiol. 2003; 91(9A):4F-9F.
15. Wang TJ, Levy D, Benjamin EJ, Vasan RS. The epidemiology of “asymptomatic” left ventricular systolic dysfunction: implications for screening. Ann Intern Med. 2003; 138(11):907-916.
16. Kuznetsova T, Herbots L, López B, et al. Prevalence of left ventricular diastolic dysfunction in a general population. Circ Heart Fail. 2009; 2(2):105-112.
17.Belham M, Kruger A, Mepham S, Faganello G, Pritchard C. Monitoring left ventricular function in adults receiving anthracycline-containing chemotherapy. Eur J Heart Fail. 2007; 9(4):409-414.
18. Smith LA, Cornelius VR, Plummer CJ, et al. Cardiotoxicity of anthracycline agents for the treatment of cancer: systematic review and meta-analysis of randomised controlled trials. BMC Cancer. 2010; 10:337.
19. Jiji RS, Kramer CM, Salerno M. Non-invasive imaging and monitoring cardiotoxicity of cancer therapeutic drugs. J Nucl Cardiol. 2012; 19(2):377-388.
20. Yoon GJ, Telli ML, Kao DP, Matsuda KY, Carlson RW, Witteles RM. Left ventricular dysfunction in patients receiving cardiotoxic cancer therapies: are clinicians responding optimally? J Am Coll Cardiol. 2010; 56(20):1644-1650.
21. Cardinale D, Colombo A, Sandri MT, et al. Prevention of high dose chemotherapy-induced cardiotoxicity in high-risk patients by angiotensin-converting enzyme inhibition. Circulation. 2006; 114(23):2474-2481.
22. Sawaya H, Sebag IA, Plana JC, et al. Assessment of echocardiography and biomarkers for the extended prediction of cardiotoxicity in patients treated with anthracyclines, taxanes, and trastuzumab. Circ Cardiovasc Imaging. 2012; 5(5):596-603.
23. Bovelli D, Plataniotis G, Roila F, ESMO Guidelines Working Group. Cardiotoxicity of chemotherapeutic agents and radiotherapy-related heart disease: ESMO Clinical Practice Guidelines. Ann Oncol. 2010; 21(suppl 5):v277-v282.
24. Ky B, French B, McCloskey K, et al. High-sensitivity ST2 for prediction of adverse outcomes in chronic heart failure. Circ Heart Fail. 2011; 4(2):180-187.
25. Gaggin HK, Motiwala S, Bhardwaj A, Parks KA, Januzzi JL Jr. Soluble concentrations of the interleukin receptor family member ST2 and b-blocker therapy in chronic heart failure. Circ Heart Fail. 2013; 6(6):1206-1213.
26. Lassus JP, Nieminen MS, Peuhkurinen K, et al; FINN-AKVA study group. Markers of renal function and acute kidney injury in acute heart failure: definitions and impact on outcomes of the cardiorenal syndrome. Eur Heart J. 2010; 31(22):2791-2798.
27. Eurlings LW, van Pol PE, Kok WE, et al. Management of chronic heart failure guided by individual N-terminal pro-Btype natriuretic peptide targets: results of the PRIMA (Can PRo-brain-natriuretic peptide guided therapy of chronic heart failure IMprove heart fAilure morbidity and mortality?) study. J Am Coll Cardiol. 2010; 56(25):2090-2100.
28. Shah MR, Califf RM, Nohria A, et al. The STARBRITE trial: a randomized, pilot study of B-type natriuretic peptide-guided therapy in patients with advanced heart failure [published correction appears in J Card Fail. 2011; 17(9):788]. J Card Fail.
2011; 17(8):613-621.
29. Felker GM, Hasselblad V, Hernandez AF, O’Connor CM. Biomarker-guided therapy in chronic heart failure: a metaanalysis of randomized controlled trials. Am Heart J. 2009; 158(3): 422-430.
30. Porapakkham P, Porapakkham P, Zimmet H, Billah B, Krum H. B-type natriuretic peptide-guided heart failure therapy: a meta-analysis. Arch Intern Med. 2010; 170(6):507-514.
31. Owan TE, Hodge DO, Herges RM, Jacobsen SJ, Roger VL, Redfield MM. Trends in prevalence and outcome of heart failure with preserved ejection fraction. N Engl J Med. 2006; 355(3):251-259.
32. Lee DS, Gona P, Vasan RS, et al. Relation of disease pathogenesis and risk factors to heart failure with preserved or reduced ejection fraction: insights from the Framingham Heart Study of the National Heart, Lung, and Blood Institute. Circulation 2009; 119(24):3070-3077.
33. Bursi F, Weston SA, Redfield MM, et al. Systolic and diastolic heart failure in the community. JAMA. 2006; 296(18):2209-2216.
34. Henkel DM, Redfield MM, Weston SA, Gerber Y, Roger VL. Death in heart failure: a community perspective. Circ Heart Fail. 2008; 1(2):91-97.
35. Lund LH, Benson L, Dahlström U, Edner M. Association between use of renin-angiotensin system antagonists and mortality in patients with heart failure and preserved ejection fraction. JAMA. 2012; 308(20):2108-2117.
36. Kitzman DW, Hundley WG, Brubaker PH, et al. A randomized double-blind trial of enalapril in older patients with heart failure and preserved ejection fraction: effects on exercise tolerance and arterial distensibility. Circ Heart Fail. 2010; 3(4):477-485.
37. Massie BM, Carson PE, McMurray JJ, et al; I-PRESERVE Investigators. Irbesartan in patients with heart failure and preserved ejection fraction. N Engl J Med. 2008; 359(23):2456-2467.
38. Yusuf S, Pfeffer MA, Swedberg K, et al; CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet. 2003; 362(9386):777-781.
39. Redfield MM, Chen HH, Borlaug BA, et al; RELAX Trial. Effect of phosphodiesterase-5 inhibition on exercise capacity and clinical status in heart failure with preserved ejection fraction: a randomized clinical trial. JAMA. 2013; 309(12):1268-1277.
40. Deswal A, Richardson P, Bozkurt B, Mann DL. Results of the Randomized Aldosterone Antagonism in Heart Failure with Preserved Ejection Fraction trial (RAAM-PEF). J Card Fail. 2011; 17(8):634-642.
41. Pfeffer MA, McKinlay S, Pitt B, et al. Treatment of preserved cardiac function heart failure with an aldosterone Antagonist (TOPCAT). Circulation. 2013; 128(24):2704-2722.
42. Verloop WL, Beeftink MM, Nap A, et al. Renal denervation in heart failure with normal left ventricular ejection fraction: rationale and design of the DIASTOLE (DenervatIon of the renal Sympathetic nerves in hearT failure with nOrmal Lv Ejection fraction) trial. Eur J Heart Fail. 2013; 15(12):1429-1437.
43. Symplicity HTN-1 Investigators. Catheter-based renal sympathetic denervation for resistant hypertension: durability of blood pressure reduction out to 24 months. Hypertension. 2011; 57(5):911-917.
44. Krum H, Schlaich M, Whitbourn R, et al. Catheter-based renal sympathetic denervation for resistant hypertension: a multicentre safety and proof-of-principle cohort study. Lancet. 2009; 373(9671):1275-1281.
45. Kitzman DW, Brubaker PH, Morgan TM, Stewart KP, Little WC. Exercise training in older patients with heart failure and preserved ejection fraction: a randomized, controlled, single-blind trial. Circ Heart Fail. 2010; 3(6):659-667.
46. Zannad F, McMurray JJ, Krum H, et al; EMPHASIS-HF Study Group. Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med. 2011; 364(1):11-21.
47. Pitt B, Zannad F, Remme WJ, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure: Randomized Aldactone Evaluation Study Investigators. N Engl J Med. 1999; 341(10):709-717.
48. Hernandez AF, Mi X, Hammill BG, et al. Associations between aldosterone antagonist therapy and risks of mortality and readmission among patients with heart failure and reduced ejection fraction. JAMA. 2012; 308(20):2097-2107.
49. Tracy CM, Epstein AE, Darbar D, et al; American College of Cardiology Foundation; American Heart Association Task Force on Practice Guidelines; Heart Rhythm Society. 2012 ACCF/AHA/HRS focused update of the 2008 guidelines for device-based therapy of cardiac rhythm abnormalities: a report of the American College of Cardiology Foundation/ American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society [published correction appears in Circulation. 2013;127(3):e357ee359]. Circulation. 2012; 126(14):1784-1800.
50. Linde C, Abraham WT, Gold MR, St John Sutton M, Ghio S, Daubert C, REVERSE (REsynchronization reVErses Remodeling in Systolic left vEntricular dysfunction) Study Group. Randomized trial of cardiac resynchronization in mildly symptomatic heart failure patients and in asymptomatic patients with left ventricular dysfunction and previous heart failure symptoms. J Am Coll Cardiol. 2008; 52(23):1834-1843.
51. Moss AJ, Hall WJ, Cannom DS, et al; MADIT-CRT Trial Investigators. Cardiac-resynchronization therapy for the prevention of heart-failure events. N Engl J Med. 2009; 361(14):1329-1338.
52. Tang AS, Wells GA, Talajic M, et al; Resynchronization-Defibrillation for Ambulatory Heart Failure Trial Investigators. Cardiac- resynchronization therapy for mild-to-moderate heart failure. N Engl J Med. 2010; 363(25):2385-2395.
53. Dunlay SM, Weston SA, Redfield MM, Killian JM, Roger VL. Anemia and heart failure: a community study. Am J Med. 2008; 121(8):726-732.
54. Groenveld HF, Januzzi JL, Damman K, et al. Anemia and mortality in heart failure patients: a systematic review and metaanalysis. J Am Coll Cardiol. 2008; 52(10):818-827.
55. Anker SD, Comin Colet J, Filippatos G, et al; FAIR-HF Trial Investigators. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med. 2009; 361(25):2436-2448.
56. Okonko DO, Grzeslo A, Witkowski T, et al. Effect of intravenous iron sucrose on exercise tolerance in anemic and nonanemic patients with symptomatic chronic heart failure and iron deficiency: FERRIC-HF; a randomized, controlled, observer-blinded trial. J Am Coll Cardiol. 2008; 51(2):103-112.
57. Toblli JE, Lombraña A, Duarte P, Di Gennaro F. Intravenous iron reduces NT-pro-brain natriuretic peptide in anemic patients with chronic heart failure and renal insufficiency. J Am Coll Cardiol. 2007; 50(17):1657-1665.
58. Swedberg K, Young JB, Anand IS, et al; RED-HF Committees; RED-HF Investigators. Treatment of anemia with darbepoetin alfa in systolic heart failure.NEngl JMed. 2013; 368(13):1210-1219.
59. Fiuzat M, Neely ML, Starr AZ, et al. Association between adrenergic receptor genotypes and beta-blocker dose in heart failure patients: analysis from the HF-ACTION DNA substudy. Eur J Heart Fail. 2013; 15(3):258-266.
60. Pereira NL, Weinshilboum RM. The impact of pharmacogenomics on the management of cardiac disease. Clin Pharmacol Ther. 2011; 90(4):493-495.
61. Weintraub NL, Collins SP, Pang PS, et al; American Heart Association Council on Clinical Cardiology and Council on Cardiopulmonary, Critical Care, Perioperative and Resuscitation. Acute heart failure syndromes: emergency department presentation, treatment, and disposition: current approaches and future aims; a scientific statement from the American Heart Association. Circulation. 2010; 122(19):1975-1996.
62. Collins SP, Pang PS, Fonarow GC, Yancy CW, Bonow RO, Gheorghiade M. Is hospital admission for heart failure really necessary? the role of the emergency department and observation unit in preventing hospitalization and rehospitalization. J Am Coll Cardiol. 2013; 61(2):121-126.
63. Allen LA, Turer AT, Dewald T, Stough WG, Cotter G, O’Connor CM. Continuous versus bolus dosing of furosemide for patients hospitalized for heart failure. Am J Cardiol. 2010; 105(12):1794-1797.
64. Thomson MR, Nappi JM, Dunn SP, Hollis IB, Rodgers JE, Van Bakel AB. Continuous versus intermittent infusion of furosemide in acute decompensated heart failure. J Card Fail. 2010; 16(3):188-193.
65. Salvador DR, Rey NR, Ramos GC, Punzalan FE. Continuous infusion versus bolus injection of loop diuretics in congestive heart failure. Cochrane Database Syst Rev. 2005; (3):CD003178.
66. Felker GM, Lee KL, Bull DA, et al; NHLBI Heart Failure Clinical Research Network. Diuretic strategies in patients with acute decompensated heart failure. N Engl J Med. 2011; 364(9): 797-805.
67. Bart BA, Goldsmith SR, Lee KL, et al. Cardiorenal rescue study in acute decompensated heart failure: rationale and design of CARRESS-HF, for the Heart Failure Clinical Research Network. J Card Fail. 2012; 18(3):176-182.
68. Giamouzis G, Butler J, Starling RC, et al. Impact of dopamine infusion on renal function in hospitalized heart failure patients: results of the Dopamine in Acute Decompensated Heart Failure (DAD-HF) Trial. J Card Fail. 2010; 16(12):922-930.
69. Chen HH, Anstrom KJ, Givertz MM, et al; NHLBI Heart Failure Clinical Research Network. Low-dose dopamine or low-dose nesiritide in acute heart failure with renal dysfunction: the ROSE acute heart failure randomized trial. JAMA. 2013; 310(23):2533-2543.
70. Colucci WS, Elkayam U, Horton DP, et al; Nesiritide Study Group. Intravenous nesiritide, a natriuretic peptide, in the treatment of decompensated congestive heart failure [published corrections appear in N Engl J Med. 2000; 343(20):1504; N Engl J Med. 2000;343(12):896]. N Engl J Med. 2000; 343(4):246-253.
71. Publication Committee for the VMAC Investigators (Vasodilatation in the Management of Acute CHF). Intravenous nesiritide vs nitroglycerin for treatment of decompensated congestive heart failure: a randomized controlled trial [published correction appears in JAMA. 2002; 288(5):577]. JAMA. 2002;287(12):1531-1540.
72. Sackner-Bernstein JD, Skopicki HA, Aaronson KD. Risk of worsening renal function with nesiritide in patients with acutely decompensated heart failure [published correction appears in Circulation. 2005; 111(17):2274]. Circulation. 2005; 111(12):1487-1491.
73. O’Connor CM, Starling RC, Hernandez AF, et al. Effect of nesiritide in patients with acute decompensated heart failure [published correction appears in N Engl J Med. 2011;365(8): 773]. N Engl J Med. 2011; 365(1):32-43.
74. Eapen ZJ, Reed SD, Curtis LH, Hernandez AF, Peterson ED. Do heart failure disease management programs make financial sense under a bundled payment system? Am Heart J. 2011; 161(5): 916-922.
75. Jencks SF, Williams MV, Coleman EA. Rehospitalizations among patients in the Medicare fee-for-service program [published correction appears in N Engl J Med. 2011; 364(16): 1582]. N Engl J Med. 2009; 360(14):1418-1428.
76. Bradley EH, Curry L, Horwitz LI, et al. Contemporary evidence about hospital strategies for reducing 30-day readmissions: a national study. J Am Coll Cardiol. 2012; 60(7):607-614.
77. Bradley EH, Curry L, Horwitz LI, et al. Hospital strategies associated with 30-day readmission rates for patients with heart failure. Circ Cardiovasc Qual Outcomes. 2013; 6(4):444-450.
78. Costanzo MR, Mills RM, Wynne J. Characteristics of “Stage D” heart failure: insights from the Acute Decompensated Heart Failure National Registry Longitudinal Module (ADHERE LM). Am Heart J. 2008; 155(2):339-347.
79. Allen LA, Stevenson LW, Grady KL, et al; American Heart Association; Council on Quality of Care and Outcomes Research; Council on Cardiovascular Nursing; Council on Clinical Cardiology; Council on Cardiovascular Radiology and Intervention; Council on Cardiovascular Surgery and Anesthesia. Decision making in advanced heart failure: a scientific statement from the American Heart Association. Circulation. 2012; 125(15):1928-1952.
80. Rose EA, Gelijns AC, Moskowitz AJ, et al; Randomized Evaluation of Mechanical Assistance for the Treatment of Congestive Heart Failure (REMATCH) Study Group. Long-term use of a left ventricular assist device for end-stage heart failure. N Engl J Med. 2001; 345(20):1435-1443.
81. Slaughter MS, Rogers JG, Milano CA, et al; HeartMate II Investigators. Advanced heart failure treated with continuous-flow left ventricular assist device. N Engl J Med. 2009; 361(23):2241-2251.
82. Hasin T, Marmor Y, Kremers W, et al. Readmissions after implantation of axial flow left ventricular assist device. J Am Coll Cardiol. 2013; 61(2):153-163.
83. Crow S, Chen D, Milano C, et al. Acquired von Willebrand syndrome in continuous-flow ventricular assist device recipients. Ann Thorac Surg. 2010; 90(4):1263-1269.
84. Uriel N, Pak SW, Jorde UP, et al. Acquired von Willebrand syndrome after continuous-flow mechanical device support contributes to a high prevalence of bleeding during Mayo Clin long-term support and at the time of transplantation. J Am Coll Cardiol. 2010; 56(15):1207-1213.
85. Kirklin JK, Naftel DC, Kormos RL, et al. Fifth INTERMACS annual report: risk factor analysis from more than 6,000 mechanical circulatory support patients. J Heart Lung Transplant. 2013; 32(2):141-156.
86. Forest SJ, Bello R, Friedmann P, et al. Readmissions after ventricular assist device: etiologies, patterns, and days out of hospital. Ann Thorac Surg. 2013; 95(4):1276-1281.
87. Fine NM, Topilsky Y, Oh JK, et al. Role of echocardiography in patients with intravascular hemolysis due to suspected continuous-flow LVAD thrombosis. J Am Coll Cardiol Img. 2013; 6(11):1129-1140.
88. Topilsky Y, Hasin T, Oh JK, et al. Echocardiographic variables after left ventricular assist device implantation associated with adverse outcome. Circ Cardiovasc Imaging. 2011; 4(6):648-661.
89. Topilsky Y, Oh JK, Atchison FW, et al. Echocardiographic findings in stable outpatients with properly functioning HeartMate II left ventricular assist devices. J Am Soc Echocardiogr. 2011; 24(2):157-169.
90. Rogers JG, Bostic RR, Tong KB, Adamson R, Russo M, Slaughter MS. Cost-effectiveness analysis of continuous-flow left ventricular assist devices as destination therapy. Circ Heart Fail. 2012; 5(1):10-16.
91. Noyes K, Veazie P, Hall WJ, et al. Cost-effectiveness of cardiac resynchronization therapy in the MADIT-CRT trial. J Cardiovasc Electrophysiol. 2013; 24(1):66-74.
92. Jeevanandam V. Are we ready to implant left ventricular assist devices in “less sick” patients? Semin Thorac Cardiovasc Surg. 2012; 24(1):8-10.
93. Topilsky Y, Pereira NL, Shah DK, et al. Left ventricular assist device therapy in patients with restrictive and hypertrophic cardiomyopathy. Circ Heart Fail. 2011; 4(3):266-275.
94. Stewart GC, Givertz MM. Mechanical circulatory support for advanced heart failure: patients and technology in evolution. Circulation. 2012; 125(10):1304-1315.
95. Meyns B, Klotz S, Simon A, et al. Proof of concept: hemodynamic response to long-term partial ventricular support with the synergy pocket micro-pump. J Am Coll Cardiol. 2009; 54(1):79-86.
96. Saito S, Sakaguchi T, Miyagawa S, et al. Biventricular support using implantable continuous-flow ventricular assist devices. J Heart Lung Transplant. 2011; 30(4):475-478.
97. Hetzer R, Krabatsch T, Stepanenko A, Hennig E, Potapov EV. Long-term biventricular support with the HeartWare implantable continuous flow pump [letter]. J Heart Lung Transplant. 2010; 29(7):822-824.
98. Desai AS, Stevenson LW. Rehospitalization for heart failure: predict or prevent? Circulation. 2012; 126(4):501-506.
99. Dunlay SM, Shah ND, Shi Q, et al. Lifetime costs of medical care after heart failure diagnosis. Circ Cardiovasc Qual Outcomes. 2011; 4(1):68-75.
100. ES F. The Dartmouth Atlas of Health Care. In: KK B, ed. End of Life Care; 2007. http://www.dartmouthatlas.org/data/topic/ topic.aspx?cat¼18 . Accessed January 31, 2014.
101. Levy WC, Mozaffarian D, Linker DT, et al. The Seattle Heart Failure Model: prediction of survival in heart failure. Circulation. 2006; 113(11):1424-1433.
102. Dunlay SM, Swetz KM, Mueller PS, Roger VL. Advance directives in community patients with heart failure. Circ Cardiovasc Qual Outcomes. 2012; 5(3):283-289.
103. Adler ED, Goldfinger JZ, Kalman J, Park ME, Meier DE. Palliative care in the treatment of advanced heart failure. Circulation. 2009; 120(25):2597-2606.
104. Whitford K, Shah ND, Moriarty J, Branda M, Thorsteinsdottir B. Impact of a palliative care consult service [published online ahead of print April 2, 2013]. Am J Hosp Palliat Care. http://dx.doi.org/10.1177/1049909113482746.
105. Morrison RS, Penrod JD, Cassel JB, et al; Palliative Care Leadership Centers’ Outcomes Group. Cost savings associated with US hospital palliative care consultation programs. Arch Intern Med. 2008; 168(16):1783-1790.
106. Swetz KM, Kamal AH, Matlock DD, et al. Preparedness planning before mechanical circulatory support: a “how-to” guide for palliative medicine clinicians [published online ahead of print October 2, 2013]. J Pain Symptom Manage. http://dx.doi.org/10.1016/j.jpainsymman.2013.06.006



No hay comentarios:
Publicar un comentario