Abordaje quirúrgico para la sobrevida a largo plazo: El propósito de este estudio fue examinar cual era el resultado de la resección del colangiocarcinoma intrahepático en una serie de pacientes evaluados y tratados en centros hepatobiliares terciarios.
Autor(es): Dres. Ribero D, Pinna AD, Guglielmi A, Ponti A, Nuzzo G, Giulini SM, Aldrighetti L, Calise F, Gerunda GE, y col Enlace: Arch Surg 2012; 147(12): 1107-1113
Resumen
|
Introducción
El colangiocarcinoma intrahepático (CCI) es la segunda neoplasia maligna primaria más frecuente del hígado, pero sigue siendo una enfermedad relativamente rara, responsable sólo por el 4% al 14% de los nuevos tumores hepáticos diagnosticados [1-4]. Recientemente, se ha enfocado un mayor interés clínico sobre el CCI, debido a la documentación epidemiológica de un aumento paulatino mundial en su incidencia y en las tasas de mortalidad asociadas con el CCI en el último cuarto de siglo [1-3]. En Italia, el análisis de los datos provenientes de la Asociación Italiana de Tumores Registrados (AITR) mostró una epidemiología descriptiva reflejando las tendencias globales [3]. Sin embargo, la rareza de la enfermedad y la alta proporción de pacientes diagnosticados en un estado avanzado e irresecable [5], han obstaculizado la recolección de datos quirúrgicos en gran cantidad. La mayoría de los datos disponibles derivan de estudios pequeños de instituciones aisladas, reportando resultados conflictivos en términos de sobrevida global [6-20]. Por lo tanto, la eficacia y resultados de la resección quirúrgica en el CCI están aún mal definidos. Además, la falta de protocolos efectivos de neoadyuvancia o adyuvancia ha reforzado la percepción tradicional de un pronóstico sombrío. En consecuencia, es necesaria la evaluación de los beneficios potenciales a largo plazo de la resección quirúrgica en una cohorte grande de pacientes, para apoyar el abordaje quirúrgico agresivo frecuentemente requerido para tratar esos tumores. Asimismo, existen controversias en relación con el manejo quirúrgico óptimo. A pesar de los datos de numerosos estudios que han investigado la significación oncológica de la linfadenectomía [7,8,12,16], la evidencia es aún inadecuada, con muchos cirujanos de Occidente que no incluyen la linfadenectomía locorregional como parte de su abordaje rutinario del CCI. Similarmente, la cuestión de los márgenes quirúrgicos apropiados sigue sin ser adecuadamente evaluada [8,19,21-24]. En consecuencia, el propósito de este estudio fue examinar el resultado de la resección del CCI en una serie de pacientes evaluados y tratados en centros hepatobiliares terciarios. Usando una de las series más grandes jamás recolectada, los autores buscaron específicamente: (1) determinar la tasa de expectativa de vida después de una resección R0; (2) identificar los factores asociados con un pobre resultado y (3) clarificar el impacto pronóstico de los factores técnicos, llámese linfadenectomia locorregional y ancho del margen quirúrgico.
Métodos
Los datos recolectados prospectivamente de todos los pacientes consecutivos con un CCI confirmado anatomopatológicamente, que fueron sometidos a una resección hepática con intento curativo en 1 de los 16 centros terciarios de referencia (Marzo 1990 – Diciembre 2008), fueron ingresados en un registro multi-institucional. El registro y el presente estudio fueron respaldados por el Capítulo Italiano de la International Hepato-Pancreato-Biliary Association. Los pacientes con colangiocarcinoma hiliar y aquellos con CCI – carcinoma hepatocelular mixto, no fueron considerado como elegibles para el registro. La recolección de datos y el análisis fueron realizados conforme con los estándares éticos de la Declaración de Helsinki.
El estudio preoperatorio de todos los pacientes consistió en una evaluación de rutina, investigación de las pruebas séricas de laboratorio, colonoscopía y endoscopía del tracto gastrointestinal superior, tomografía computada o resonancia magnética del abdomen y radiografía o tomografía computada del tórax. Se realizó una tomografía por emisión de positrones y una biopsia hepática sólo en casos seleccionados. Los pacientes fueron considerados con enfermedad resecable, sólo si el tumor podía ser removido completamente, preservando un remanente de hígado funcional suficiente, con adecuado flujo vascular de ingreso y venoso hepático de egreso. Las metástasis a distancia, en la estadificación preoperatoria, fue la única contraindicación formal para la cirugía. Después de la resección hepática se decidió el empleo de la quimioterapia adyuvante, basado en las recomendaciones de cada equipo multidisciplinario institucional o del oncólogo del paciente. Los pacientes fueron seguidos regularmente cada 3 a 6 meses, de acuerdo con el protocolo de cada institución. Los datos del seguimiento alejado fueron actualizados el 1 de enero de 2010.
Las siguientes variables clínico-patológicas fueron registradas para cada paciente: datos demográficos, niveles preoperatorios de antígeno carcinoembrionario (CEA) y de antígeno canceroso 19-9 (CA 19-9), detalles de la operación, si hubo o no complicaciones postoperatorias, características del tumor y datos completos del seguimiento incluyendo estatus de la enfermedad y lugar de la recidiva. Todos los datos anatomopatológicos fueron revisados retrospectivamente para confirmar la consistencia de los datos recolectados prospectivamente, registrados en cada base de datos para las variables de interés: patología macroscópica (el tipo se basó en la clasificación del Liver Cancer Study Group de Japón [25]), tamaño y cantidad de tumores, diferenciación histológica, si había o no invasión vascular, estatus de los ganglios linfáticos (GL), si había o no invasión de los órganos adyacentes y la presencia de metástasis a distancia. Para cada paciente, el agrupamiento en estadios TNM fue computado de acuerdo con el criterio de la 7º edición del AJCC Cancer Staging Manual [26]. Los datos sobre el estatus del margen y del hígado subyacente también fueron registrados. En particular, el margen quirúrgico fue clasificado como positivo en pacientes con tumor expuesto a lo largo de la línea de transección o en aquellos con evidencia microscópica de células tumorales en la superficie de corte. Los datos perdidos fueron registrados como no disponibles. La morbilidad postoperatoria fue definida usando la clasificación de Dindo y col [27]. La mortalidad postoperatoria fue analizada 90 días después de la cirugía.
Las variables son presentadas como números absolutos y porcentajes o como medianas y rangos. Los análisis estadísticos de los datos fueron realizados con las pruebas no paramétricas apropiadas. La estimación de la sobrevida global fue generada con el método de Kaplan-Meier, midiendo el tiempo desde el día de la cirugía hasta la fecha de fallecimiento o del último control alejado. Los modelos de riesgos proporcionales de Cox fueron desarrollados para comprobar la asociación de los factores clínico-patológicos relevantes con la sobrevida. Todos los factores con una P univariada < 0,100, con excepción de aquellos en riesgo de multicolinearidad (específicamente estadio T y factores de estadificación de la AJCC), fueron considerados para la comparación independiente utilizando un modelo multivariable. Para superar las limitaciones de un análisis multivariable de un conjunto de datos conteniendo valores perdidos, se efectuó un segundo análisis empleando la imputación de regresión para los datos extraviados [28]. La imputación de regresión se aplicó a un modelo que incluyó sólo las variables seleccionadas con un procedimiento paso a paso; todas las otras variables del modelo multivariable fueron usadas para llenar los datos faltantes. Para evaluar el beneficio potencial de la linfadenectomía, se computó el índice de valor terapéutico, calculado multiplicando la frecuencia de metástasis en los GL y la tasa de sobrevida a 5 años de los pacientes con metástasis en los GL [29]. La significación estadística fue ajustada a una P < 0,50. El paquete estadístico R, versión 2.13.0 (The R Foundation for Statistical Computing, Viena, Austria) fue usado para los análisis estadísticos.
Resultados
Características de los pacientes
En total, se registraron 434 pacientes. Hubo 243 hombres (56,0%) y 191 mujeres (44,0%), con una edad media de 65 años (rango 28-85 años). De esos 434 pacientes, 39 (8,9%) fueron positivos para el antígeno de superficie de la hepatitis B y 53 (12,2%) para la presencia de anticuerpo para hepatitis C (7 pacientes tenían una co-infección con virus de hepatitis B y C). Preoperatoriamente, 195 de 325 pacientes (60,0%; 109 pacientes [25,1%] no fueron testeados), tenían un nivel elevado (>37 U/mL) del antígeno CA 19-9 (mediana 57,1 U/mL; rango 0,2-27.000 U/mL). Contrariamente, se detectó un nivel elevado de CEA (>5 ng/mL) sólo en 77 de 288 pacientes (26,7%; 146 pacientes [33,6%] no fueron testeados) (mediana 2,3 ng/mL; rango 0,1-36.000 ng/mL). Sesenta pacientes (13,8%) se presentaron con ictericia obstructiva, 37 de los cuales (61,6%) fueron sometidos a un drenaje biliar preoperatorio.
Resultados quirúrgicos
El tipo y extensión de los procedimientos quirúrgicos son detallados en la Tabla 1. Durante el período postoperatorio, 151 pacientes (34,8%) experimentaron un total de 182 eventos adversos. Las complicaciones estuvieron primariamente relacionadas con el hígado (43,9%), incluyendo disfunción hepática / insuficiencia hepática (16 y 22 pacientes, respectivamente) y fístula biliar (42 pacientes). Las complicaciones infecciosas (34 de 182 pacientes [18,7%]) fueron la segunda causa más común de morbilidad, siendo más comunes los abscesos subfrénicos, neumonía y sepsis. Globalmente, 89 de 434 pacientes (20,5%) desarrollaron complicaciones mayores (grados III-IV), con una tasa de reoperación de 3,7% (16 pacientes). Para señalar, la morbilidad fue significativamente más alta en pacientes que habían sido sometidos a drenaje biliar (67,5%) (P = 0,058), comparado con los pacientes con ictericia que no fueron sometidos a drenaje biliar (43,5%) y comparado con los pacientes sin ictericia (31,3%) (P <0,001). En total, 23 pacientes (5,3%) fallecieron postoperatoriamente. Después de dividir la serie en 3 grupos usando tercios, la tasa de mortalidad disminuyó desde el 6,2% en los primeros dos tercios de pacientes a 3,5% en el último tercio. No obstante, ese descenso de la mortalidad, que se observó a pesar de una complejidad similar de las resecciones, no fue estadísticamente significativo (P = 0,24). La mediana de la estadía hospitalaria fue de 12 días (rango, 1-114 días) desde el día de la operación. Después de la resección, 124 pacientes (30,2%) recibieron tratamientos adyuvantes, sea quimioterapia (116 pacientes) o radioterapia (8 pacientes).
• TABLA 1: Datos sobre los procedimientos quirúrgicos realizados en pacientes que fueron sometidos a hepatectomía con intención curativa por colangiocarcinoma intrahepático
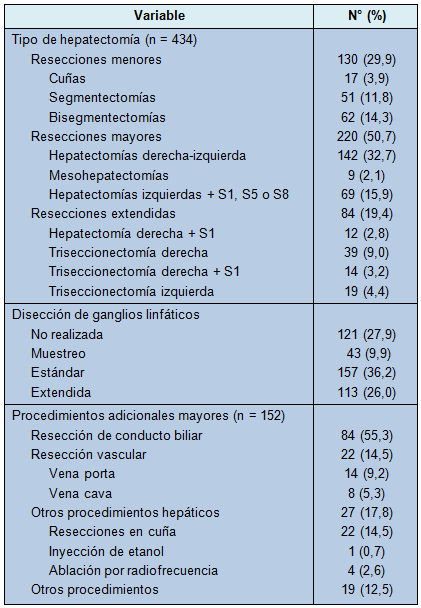
S1: segmento 1. S5: segmento 5. S8: segmento 8
Hallazgos anatomopatológicos
Las características descriptivas anatomopatológicas de la cohorte en estudio se detallan en la Tabla 2. La incidencia global de metástasis en los GL fue de 36,9% en pacientes que fueron sometidos a alguna forma de disección de los GL. Un tamaño tumoral aumentado, la mayor incidencia de compromiso ganglionar (≤ 3 cm, 24,4% de los pacientes; 3,1-5 cm, 32,8% de los pacientes; 5,1-10 cm, 38,6% de los pacientes y ≥ 10 cm, 51,6% de los pacientes [P = 0,012]).
En el análisis anatomopatológico final, 52 pacientes (12,0%) tenían un margen de resección positivo. La mediana del ancho del margen libre de tumor fue de 10 mm (rango, 0,5-40 mm). La estratificación para el ancho del margen fue: 0,5-9 mm (mediana 4 mm) para 133 pacientes (30,6%) y 1 cm o más (mediana 15 mm) para 159 pacientes (36,6%). Los datos sobre el ancho del margen no estuvieron disponibles en 90 pacientes (20,7%) y los datos sobre el estatus del margen no estuvieron disponibles en 5 pacientes (1,2%). Globalmente, 67 pacientes (15,4%) fueron clasificados como habiendo recibido una resección R1. Las causas de las resecciones que no fueron radicales fueron: márgenes de resección positivos (52 pacientes), descubrimiento intraoperatorio de implantes peritoneales (12 pacientes) aunque con resección completa, GL paracavales positivos (1 paciente) y CCI en el remanente hepático (2 pacientes). Esos 2 últimos pacientes, en quienes se planificó inicialmente una hepatectomía en 2 tiempos, no fueron sometidos a la segunda resección, a causa de la progresión del tumor.
Sobrevida global y factores pronósticos
Al momento de efectuarse el análisis, 218 de 411 pacientes (53,0%) habían fallecido. Después de un seguimiento alejado con una mediana de 36,5 meses (rango, 1-181 meses), la mediana de la sobrevida global fue de 33 meses (95% intervalo de confianza [IC], 27,0-39,1 meses) y los estimados a 1, 3 y 5 años fueron de 82,3%, 47,1% y 32,9%, respectivamente. Después de una resección R0, los estimados correspondientes de sobrevida fueron de 39 meses (95% IC, 28,7-49,2 meses) y los estimados a 1, 3 y 5 años fueron del 84,8%, 50,6% y 39,8%, respectivamente. El paciente que sobrevivió por más tiempo estuvo vivo y libre de enfermedad durante 15,1 años, con 47 pacientes con sobrevida actual de 5 años (26,8%) de los 175 con al menos 5 años de seguimiento alejado. De esos pacientes, 31 no tenían evidencia de enfermedad para una tasa mínima de curación del 17,7%.
Los predictores univariados y multivariados de sobrevida global se reportan en la Tabla 3. En el análisis univariado, un nivel preoperatorio elevado de CA 19-9, todos los factores tumorales anatomopatológicos (con la excepción del tipo macroscópico y de la invasión perineural), y la radicalidad de la resección, se correlacionaron con la sobrevida. En el análisis multivariado, sólo las metástasis en los GL (OR 2,21 [95% IC, 1,55-3,15]; P = 0,005), los tumores múltiples (OR 1,50 [95% IC, 1,11-2,04]; P < 0,001) y un nivel preoperatorio elevado del CA 19-9 (OR 1,62 [95% IC, 1,15-2,30]; P = 0,006) permanecieron como predictores independientes de pobre sobrevida. Se obtuvieron resultados similares en el segundo conjunto de análisis usando la imputación de regresión para el manejo de datos perdidos. Las tasas de riesgo correspondientes fueron de 2,01 (95% IC, 1,49-2,72) para las metástasis en los GL (P < 0,001), 1,57 (95% IC, 1,16-2,10) para los tumores múltiples (P = 0,004) y 1,60 (95% IC, 1,16-2,21) para el nivel elevado preoperatorio del CA 19-9 (P = 0,004).
Implicaciones para el manejo quirúrgico
Primero, dado que la presencia de metástasis ganglionares emerge como el determinante independiente más poderoso de la sobrevida, los autores de este trabajo intentaron evaluar el potencial beneficio en la sobrevida de la linfadenectomía. La tasa global de sobrevida a 5 años en los pacientes que tenían GL positivos fue de 15,9%. El índice de valor terapéutico para el beneficio de la sobrevida fue calculado como de 5,9 puntos (15,9 x 0,369). Notablemente, sólo 2 pacientes desarrollaron una linforrea clínicamente significativa.
Segundo, se investigó el significado pronóstico del margen de resección. En particular, los autores comprobaron su hipótesis previa de que todas las hepatectomías con márgenes negativos (> 0 mm), independientemente del ancho del margen, deberían ser consideradas como resecciones radicales. Encontraron que el ancho de un margen negativo no tuvo un impacto a largo plazo, porque los estimados de sobrevida en pacientes con márgenes negativos de 0,5 a 9 mm y los estimados de sobrevida en pacientes con márgenes negativos de 1 cm o más, fueron similares (P = 0,61) y significativamente mejores que aquellos en los pacientes con márgenes positivos (73,6% vs 53,9%; P =0,005); en los pacientes con margen negativo, el ancho del margen no predijo la recidiva del tumor o el sitio de recurrencia (P > 0,05 para todos).
Comentarios
El CCI sigue siendo una neoplasia rara a pesar de un aumento paulatino en su incidencia y en las tasas de mortalidad mundiales asociadas con el mismo [1-3]. Aunque la resección hepática es el único tratamiento curativo, la rareza de la enfermedad ha obstaculizado un progreso significativo en términos de abordaje quirúrgico y resultados. Además, dado que aún están faltando los protocolos efectivos de adyuvancia, el pronóstico es generalmente percibido como insatisfactorio [6-15,17,19,22,30]. En contraste, el presente estudio, que analiza una de las mayores series contemporáneas de CCI resecados en centros terciarios de referencia, brinda nueva evidencia apoyando la efectividad de un abordaje quirúrgico agresivo. Primero, la adopción de un riguroso proceso de selección de pacientes resultó en una resección formalmente curativa (R0) en el 84,6% de los pacientes, una tasa significativamente mayor que la reportada en la mayoría de las series [6-20,22,30,31]. El tipo de cirugía, que involucró hepatectomías mayores o extendidas en el 70% de los pacientes y la asociación de procedimientos adicionales en un tercio de los pacientes, pudo haber contribuido a ese resultado. Interesantemente, ese abordaje quirúrgico agresivo no se trasladó a un riesgo perioperatorio prohibitivo. Por el contrario, en los años más recientes, la tasa de mortalidad se ha reducido casi a la mitad, un hecho que refleja probablemente el progreso en las técnicas quirúrgicas y el cuidado perioperatorio. Se puede hipotetizar que esa experiencia creciente, al facilitar la selección de procedimientos quirúrgicos complejos tales como las hepatectomías extendidas, puede brindar una chance para la curación de pacientes con tumores anteriormente no resecables. Segundo, la tasa de sobrevida a 5 años del 39,8% excede los estimados de sobrevida reportados en la mayoría de las series de centros aislados [6-20,22,30]. Aunque los reportes retrospectivos basados en cooperaciones multi-institucionales tienen limitaciones intrínsecas, en el presente estudio, la recolección de datos de múltiples centros, pudo haber reducido los posibles desvíos en la selección de pacientes y derivaciones. Por lo tanto, los resultados de los datos aquí presentados sobre la sobrevida a largo plazo, tanto actuarial como real, deberían ser considerados como remarcables y repetibles.
El presente estudio es importante también porque, al analizar una cohorte de más de 400 pacientes, brinda resultados robustos y generalizables sobre el significado pronóstico de varios factores clínico-patológicos. Esos resultados son cruciales, no sólo para predecir un pronóstico después de la resección, sino también para permitir una estratificación precisa de los pacientes en la investigación clínica, basada en el riesgo individual de muerte. No obstante, en la actualidad, a pesar de los resultados promisorios en términos de progresión de la sobrevida libre de enfermedad y de la respuesta del tumor obtenida con la quimioterapia en pacientes con cáncer irresecable del tracto biliar [32,33], los autores consideran que sus hallazgos no pueden ser usados para recomendar rutinariamente tratamiento neoadyuvante para los pacientes con riesgo alto y tumores resecables. Han hallado que el determinante independiente más importante para la sobrevida fue la presencia de metástasis en los GL y que el 36,6% de los pacientes que tuvo evaluación de sus GL, tenía enfermedad en estadio N1, un porcentaje similar al señalado en reportes previos [11-16,18,22,30]. Aunque algunos cirujanos de Occidente aún son reticentes a realizar rutinariamente una linfadenectomía locorregional [18,22,30] como un agregado, los hallazgos de este trabajo argumentan en favor de incluir ese procedimiento como un abordaje estándar, para todos los pacientes sometidos a hepatectomía por CCI. Ese paso quirúrgico, de hecho, es esencial para una estadificación precisa como tumores N1, en una proporción significativa de pacientes que podrían ser candidatos para terapias adyuvantes. Es digno de destacar que eso es también verdadero para los pacientes con tumores CCI muy pequeños. Los autores encontraron que el 24,4% de los pacientes con CCI de 3 cm de diámetro o menores, tenían metástasis en los GL, un porcentaje que aumenta progresivamente con el incremento del tamaño del tumor. Son conscientes de que esa incidencia podría estar sobreestimada, porque aproximadamente un tercio de los pacientes (27,9%) no fue sometido a linfadenectomía. Sin embargo, la prevalencia de pacientes con enfermedad N1 entre aquellos con CCI de 3 cm o menos de diámetro, podría haber sido del 15%, si todos los tumores NX hubieran sido considerados como N0.
Además de su relevancia en la estadificación, una disección sistemática de los GL tiene el potencial teórico de mejorar la sobrevida a largo plazo. No obstante, eso no ha sido aún comprobado. En efecto, una demostración directa de tasas más altas de sobrevida en pacientes que han sido sometidos a linfadenectomía versus aquellos que no es imposible porque, para los pacientes que no fueron sometidos a disección de los GL, no puede determinarse el estatus N. Por lo tanto, los autores de este trabajo usaron el concepto del índice de valor terapéutico, que se obtiene al multiplicar la incidencia de metástasis en los GL por la tasa de sobrevida a 5 años, de los pacientes con enfermedad N1. Ese índice, que brinda una estimación del beneficio de la linfadenectomía en la sobrevida, se basa en la asunción de que ninguno de los pacientes que sobrevivió por 5 años después de la resección de metástasis en los GL lo hubiera hecho, si los GL comprometidos hubieran sido dejados in situ. Aunque el valor del índice para determinar la indicación para una linfadenectomía sistemática no puede ser definido, usándolo, los autores pudieron comparar áreas de GL en términos del valor terapéutico de una disección ganglionar. Notablemente, el índice de valor terapéutico de ellos (5,9) fue similar al obtenido por Ueno y col. [29], cuando estos autores evaluaron el beneficio de la remoción de los GL mesorrectales en pacientes con cáncer bajo avanzado de recto. En dichos pacientes, ninguno podría argüir sobre lo apropiado de la resección mesorrectal. Similarmente, los autores de presente trabajo pueden inferir que, para los pacientes con CCI, una linfadenectomía de rutina podría añadir una ventaja potencial sin incrementar el riesgo quirúrgico. En efecto, ellos notaron que sólo 2 de 313 pacientes que tuvieron una disección de los GL desarrollaron una linforrea clínicamente significativa, la única complicación que puede ser correlacionada directamente con ese paso quirúrgico específico. Además, la remoción de los GL metastásicos puede reducir el riesgo de recidiva local, similar a lo que ha sido reportado en el cáncer pancreático [34]. Una de las limitaciones de este estudio es que no pudo determinar el sitio de las metástasis en los GL en los pacientes con enfermedad N1 y, por lo tanto, la extensión más apropiada de la linfadenectomía. Sin embargo, los autores creen que una disección sistemática de los GL debería incluir, al menos, el primer escalón ganglionar [25].
El segundo aspecto “técnico” mayor que merece consideración para definir el abordaje quirúrgico estándar para el CCI es el margen de resección. En efecto, el margen óptimo necesario para mejorar la sobrevida y reducir el riesgo de recidiva es aún incierto [8,19,21-24]. En consecuencia, los autores de este trabajo comprobaron si su definición de un margen óptimo (> 0 mm) era oncológicamente adecuada. Los datos indicaron que, similar a las metástasis hepáticas colorrectales [35], el estatus más que el ancho del margen es lo relevante para el pronóstico. Por lo tanto, cualquier resección con margen negativo debería ser considerada como una operación radical. Además, reportaron que las tasas de sobrevida en los pacientes con un margen positivo (el 65,1% de los pacientes vivió por 1 año después de la cirugía; 37,7% por 3 años y 4,7% por 5 años), aunque significativamente inferiores a la de los pacientes que tuvieron un margen de resección negativo, se comparan favorablemente con el tiempo de sobrevida de 6 a 12 meses observado para los pacientes que fueron manejados con tratamientos paliativos {1]. Sin embargo, esos datos deberían ser interpretados a la luz de posibles desvíos, debido a los valores perdidos o a la ausencia de información sobre la técnica de resección (aplastamiento con pinzas de Kelly vs disección con ultrasonido).
En conclusión, la resección hepática sigue siendo la única chance de curación para los pacientes con CCI. Los resultados de este trabajo apoyan un abordaje quirúrgico agresivo que resulta en una tasa de resección R0 alta y mejora la sobrevida a largo plazo.
Artículos relacionados
Referencias bibliográficas
1. Shaib YH, Davila JA, McGlynn K, El-Serag HB. Rising incidence of intrahepatic cholangiocarcinoma in the United States: a true increase? J Hepatol. 2004;40(3):472-477
2. Patel T. Increasing incidence and mortality of primary intrahepatic cholangiocarcinoma in the United States. Hepatology. 2001;33(6):1353-1357
3. Alvaro D, Crocetti E, Ferretti S, Bragazzi MC, Capocaccia R.AISF Cholangiocarcinoma committee. Descriptive epidemiology of cholangiocarcinoma in Italy. Dig Liver Dis. 2010;42(7):490-495
4. McGlynn KA, Tarone RE, El-Serag HB. A comparison of trends in the incidence of hepatocellular carcinoma and intrahepatic cholangiocarcinoma in the United States. Cancer Epidemiol Biomarkers Prev. 2006;15(6):1198-1203
5. Tan JC, Coburn NG, Baxter NN, Kiss A, Law CH. Surgical management of intrahepatic cholangiocarcinoma—a population-based study. Ann Surg Oncol. 2008;15(2):600-608
6. Weimann A, Varnholt H, Schlitt HJ, et al. Retrospective analysis of prognostic factors after liver resection and transplantation for cholangiocellular carcinoma. Br J Surg. 2000;87(9):1182-1187
7. Isa T, Kusano T, Shimoji H, Takeshima Y, Muto Y, Furukawa M. Predictive factors for long-term survival in patients with intrahepatic cholangiocarcinoma. Am J Surg. 2001;181(6):507-511
8. Uenishi T, Hirohashi K, Kubo S, Yamamoto T, Yamazaki O, Kinoshita H. Clinicopathological factors predicting outcome after resection of mass-forming intrahepatic cholangiocarcinoma. Br J Surg. 2001;88(7):969-974
9. Kawarada Y, Yamagiwa K, Das BC. Analysis of the relationships between clinicopathologic factors and survival time in intrahepatic cholangiocarcinoma. Am J Surg. 2002;183(6):679-685
10. Nakagawa T, Kamiyama T, Kurauchi N, et al. Number of lymph node metastases is a significant prognostic factor in intrahepatic cholangiocarcinoma. World J Surg. 2005;29(6):728-733
11. Nakagohri T, Kinoshita T, Konishi M, Takahashi S, Gotohda N. Surgical outcome and prognostic factors in intrahepatic cholangiocarcinoma. World J Surg. 2008;32(12):2675-2680
12. Shimada K, Sano T, Nara S, et al. Therapeutic value of lymph node dissection during hepatectomy in patients with intrahepatic cholangiocellular carcinoma with negative lymph node involvement. Surgery. 2009;145(4):411-416
13. Lang H, Sotiropoulos GC, Sgourakis G, et al. Operations for intrahepatic cholangiocarcinoma: single-institution experience of 158 patients. J Am Coll Surg. 2009;208(2):218-228
14. Guglielmi A, Ruzzenente A, Campagnaro T, et al. Intrahepatic cholangiocarcinoma: prognostic factors after surgical resection. World J Surg. 2009;33(6):1247-1254
15. Jonas S, Thelen A, Benckert C, et al. Extended liver resection for intrahepatic cholangiocarcinoma: a comparison of the prognostic accuracy of the fifth and sixth editions of the TNM classification. Ann Surg. 2009;249(2):303-309
16. Choi SB, Kim KS, Choi JY, et al. The prognosis and survival outcome of intrahepatic cholangiocarcinoma following surgical resection: association of lymph node metastasis and lymph node dissection with survival. Ann Surg Oncol. 2009;16(11):3048-3056
17. Shirabe K, Mano Y, Taketomi A, et al. Clinicopathological prognostic factors after hepatectomy for patients with mass-forming type intrahepatic cholangiocarcinoma: relevance of the lymphatic invasion index. Ann Surg Oncol. 2010;17(7):1816-1822
18. Ercolani G, Vetrone G, Grazi GL, et al. Intrahepatic cholangiocarcinoma: primary liver resection and aggressive multimodal treatment of recurrence significantly prolong survival. Ann Surg. 2010;252(1):107-114
19. Tamandl D, Herberger B, Gruenberger B, Puhalla H, Klinger M, Gruenberger T. Influence of hepatic resection margin on recurrence and survival in intrahepatic cholangiocarcinoma. Ann Surg Oncol. 2008;15(10):2787-2794
20. Endo I, Gonen M, Yopp AC, et al. Intrahepatic cholangiocarcinoma: rising frequency, improved survival, and determinants of outcome after resection. Ann Surg. 2008;248(1):84-96
21. Shimada K, Sano T, Sakamoto Y, Esaki M, Kosuge T, Ojima H. Clinical impact of the surgical margin status in hepatectomy for solitary mass-forming type intrahepatic cholangiocarcinoma without lymph node metastases. J Surg Oncol. 2007;96(2):160-165
22. Farges O, Fuks D, Boleslawski E, et al. Influence of surgical margins on outcome in patients with intrahepatic cholangiocarcinoma: a multicenter study by the AFC-IHCC-2009 study group. Ann Surg. 2011;254(5):824-829, discussion 830
23. Cho SY, Park SJ, Kim SH, et al. Survival analysis of intrahepatic cholangiocarcinoma after resection. Ann Surg Oncol. 2010;17(7):1823-1830
24. Konstadoulakis MM, Roayaie S, Gomatos IP, et al. Fifteen-year, single-center experience with the surgical management of intrahepatic cholangiocarcinoma: operative results and long-term outcome. Surgery. 2008;143(3):366-374
25. The Liver Cancer Study Group of Japan. Intrahepatic cholangiocarcinoma . In: The Liver Cancer Study Group of Japan, eds. Classification of Primary Liver Cancer. 1st English ed. Tokyo, Japan: Kanehara; 1997:6-7
26. Edge SB, Byrd DR, Compton CC, et al. Intrahepatic bile ducts. In: AJCC Cancer Staging Manual. 7th ed. New York, NY: Springer; 2009:201-210
27. Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg. 2004;240(2):205-213
28. Little RJA, Rubin DB. Statistical Analysis With Missing Data. New York, NY: John Wiley & Sons; 1987
29. Ueno H, Mochizuki H, Hashiguchi Y, et al. Potential prognostic benefit of lateral pelvic node dissection for rectal cancer located below the peritoneal reflection. Ann Surg. 2007;245(1):80-87
30. de Jong MC, Nathan H, Sotiropoulos GC, et al. Intrahepatic cholangiocarcinoma: an international multi-institutional analysis of prognostic factors and lymph node assessment. J Clin Oncol. 2011;29(23):3140-3145
31. Nuzzo G, Giuliante F, Ardito F, et al. Intrahepatic cholangiocarcinoma: prognostic factors after liver resection. Updates Surg. 2010;62(1):11-19
32. Gruenberger B, Schueller J, Heubrandtner U, et al. Cetuximab, gemcitabine, and oxaliplatin in patients with unresectable advanced or metastatic biliary tract cancer: a phase 2 study. Lancet Oncol. 2010;11(12):1142-1148
33. Valle J, Wasan H, Palmer DH, et al; ABC-02 Trial Investigators. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med. 2010;362(14):1273-1281
34. Capussotti L, Massucco P, Ribero D, Viganò L, Muratore A, Calgaro M. Extended lymphadenectomy and vein resection for pancreatic head cancer: outcomes and implications for therapy. Arch Surg. 2003;138(12):1316-1322
35. Pawlik TM, Scoggins CR, Zorzi D, et al. Effect of surgical margin status on survival and site of recurrence after hepatic resection for colorectal metastases. Ann Surg. 2005;241(5):715-722, discussion 722-724


No hay comentarios:
Publicar un comentario