| Tuberculosis: ¿Qué hay que saber hoy? |
Conceptos actuales: A pesar de un tratamiento barato y efectivo, la tuberculosis sigue generando millones de casos de enfermedad activa y muertes en todo el mundo.
Autor(es): Dres. Alimuddin Zumla, Mario Raviglione, Richard Hafner, C. Fordham von Reyn
Enlace: N Engl J Med 2013;368:745-55.
Resumen
Introducción
A pesar de un tratamiento barato y efectivo, la tuberculosis (TBC) sigue generando millones de casos de enfermedad activa y muertes a nivel mundial. Afecta en forma desproporcionada a las personas más pobres, tanto en los países de altos ingresos como en los países en desarrollo. Sin embargo, los últimos avances en el diagnóstico, medicamentos y vacunas, como así la mejor implementación de las intervenciones ya existentes, han favorecido la atención médica y el control global de la TBC.
Epidemiología
En 2011 había 8,7 millones de casos nuevos de TBC activa en todo el mundo (13% de los cuales estaban asociados a la coinfección con el virus de la inmunodeficiencia humana [VIH]), y 1,4 millones murieron, incluyendo 430.000 pacientes infectados con el VIH, lo que representa una escasa disminución del número pico de mediados de la década del 2000. Se ha calculado que hubo 310.000 casos incidentes de TBC resistente a múltiples fármacos, causados por organismos resistentes, al menos a la isoniazida y la rifampicina, entre los pacientes informados como tuberculosos en 2011. Más del 60% de esos pacientes eran de China, India, Federación Rusa, Pakistán y Sudáfrica.
Un total de 84 países ha informado casos de TBC ampliamente resistente a los fármacos, un subgrupo de TBC multirresistente que también es resistente a todas las fluoroquinolonas más cualquiera de los 3 fármacos antituberculosos inyectables, kanamicina, amikacina y capreomoicina. El África subsahariana ha mostrado las tasas más elevadas de TBC activa por persona, impulsada principalmente por la epidemia de VIH. El número absoluto de casos es más elevado en Asia, mientras que India y China tienen la carga más grande de enfermedad, en términos globales. En EE. UU. y la mayoría de los países de Europa occidental, gran parte de los casos ocurre en residentes de origen extranjero e inmigrantes recientes de países con TBC endémica.
Patogénesis
La fuente de Mycobacterium tuberculosis se halla en los pacientes con TBC pulmonar activa. En más del 90% de las personas infectadas con M. tuberculosis, el patógeno se encuentra en estado latente, en forma asintomática. Estudios recientes han mostrado que es posible que algunas personas adquieran y eliminen la infección aguda con M. tuberculosis.
Se calcula que el riesgo de enfermedad activa para el resto de la vida es de aproximadamente 5%. Se estima que unos 2 mil millones de personas en todo el mundo tienen infección latente y están en riesgo de reactivación. La infección latente reduce el riesgo de reinfección por la exposición repetida, mientras que la TBC activa se asocia con mayor riesgo de un segundo episodio de TBC en la reexposición.
Las cepas resistentes de M. tuberculosis provienen de mutaciones cromosómicas espontáneas, las que ocurren con una frecuencia baja predecible. La presión de selección está causada por la mala selección de fármacos antituberculosos, la monoterapia y el agregado de fármacos únicos a regímenes que han fallado, lo que da como resultado la emergencia de mutantes resistentes (resistencia adquirida).
La transmisión de tales cepas resistentes a otra persona puede provocar infección y finalmente la enfermedad (resistencia primaria). En varios lugares, especialmente donde la prevalencia de VIH es elevada, se han documentado brotes de infección resistente altamente fatal. La existencia de TBC totalmente resistente a los fármacos todavía requiere confirmación. La incapacidad para detectar la resistencia farmacológica da lugar a la prescripción de regímenes inapropiados, la falta de respuesta terapéutica, una mortalidad creciente y la posterior transmisión de TBC resistente.
Manifestaciones clínicas
Las manifestaciones clínicas clásicas de la TBC pulmonar son la tos crónica, la producción de esputo, la anorexia, el adelgazamiento, la fiebre, los sudores nocturnos y la hemoptisis. La TBC extrapulmonar ocurre en el 10 al 42% de los pacientes, dependiendo de la raza o la etnia, la edad, la presencia o ausencia de otra enfermedad subyacente, el genotipo de las cepas de M. tuberculosis y el estado inmunológico. Esta TBC, que puede afectar muchos órganos, ha variado y tiene manifestaciones proteiformes, por lo que requiere un elevado índice de sospecha.
Los pacientes con TBC activa y coinfección con VIH presentan un desafío especial para el manejo clínico. El riesgo de TBC activa aumenta rápidamente luego de la infección con VIH y en este estadio, las manifestaciones de la TBC pulmonar son similares a las de las personas VIH negativas. Con un recuento de CD4 <200/mm3, la presentación de la TBC puede ser atípica, con infiltrados tenues, derrame pleural, linfadenopatías hiliares y otras formas de TBC extrapulmonar (50% de los pacientes). Cuando el recuento de CD4 es <75 /mm3, los signos pulmonares pueden estar ausentes y la TBC diseminada, siendo sus manifestaciones las de una enfermedad febril crónica inespecífica, con compromiso orgánico y micobacteriemia, y lo que es más frecuente, con una elevada mortalidad precoz; también se ha descrito la enfermedad policlonal. Tales casos pueden ser diagnosticados erróneamente como otra enfermedad infecciosa y a menudo el diagnóstico correcto solo se hace con la autopsia.
Un cuadro común de la TBC asociada a la infección con VIH es la TBC subclínica asintomática, con hallazgos negativos en el esputo y la radiografía de tórax, y con cultivos positivos, como se observa en el 10% de los casos de regiones donde la TBC es endémica. En estas regiones, la TBC activa es subdiagnosticada en casi el 25% de los pacientes que consulta al médico por infección por VIH. Por lo tanto, se recomienda hacer estudios de detección de la TBC en todos los pacientes con infección por VIH, con el fin de identificar la enfermedad activa y antes de comenzar el tratamiento preventivo con isoniazida del resto.
La presencia de cualquiera de alguno de los siguientes síntomas, tos, fiebre, sudores nocturnos o adelgazamiento, tiene una sensibilidad del 80% para identificar a los pacientes a quienes se deberá seguir investigando, aun en regiones de bajos recursos. En las zonas donde la TBC es altamente endémica se recomienda hacer el cribado proactivo de la enfermedad ya que en los pacientes con infección por el VIH o con enfermedades no comunicables (diabetes mellitus y enfermedad pulmonar crónica relacionada con el tabaco) pueden superponerse a la TBC subclínica.
Diagnóstico
Infección latente
La detección y el tratamiento de la infección por M. tuberculosis están indicados para los grupos en los que la prevalencia de la infección latente es elevada (por ej., extranjeros procedentes de regiones donde la TBC es endémica), las personas con riesgo elevado de reactivación de la enfermedad (por ej., pacientes con infección por el VIH o diabetes, y los pacientes que recibieron inmunosupresores) y, los pacientes con ambos factores (por ej., contacto reciente con pacientes tuberculosos). La infección latente puede ser diagnosticada mediante la prueba cutánea de la tuberculina o un análisis de liberación de interferón γ. Para detectar la infección latente por M. tuberculosis en diferentes edades y grupos de riesgo, las guías específicas de los Centros para el Control y Prevención de las Enfermedades (CDC) de EE. UU., el Instituto Nacional de Salud y Excelencia Clínica en el Reino Unido (NICE) y el Centro Europeo para la Prevención y el Control de las Enfermedades recomiendan el uso de ambos estudios. La prueba cutánea de la tuberculina es más barata y por lo tanto es de preferencia en las regiones de bajos ingresos. Es tan sensible como el análisis de liberación de interferón γ, pero menos específica.
Tuberculosis activa
En la actualidad, los métodos estándar para el diagnóstico de TBC activa recomendados son la microscopía del esputo y el cultivo en medio líquido. En los países de bajos recursos, el cultivo en medio sólido es más rentable. El ensayo de liberación de interferón γ y las pruebas cutáneas de tuberculina no tienen ningún papel en el diagnóstico de TBC activa. Estas evaluaciones se pueden complementar con las pruebas de amplificación del ácido nucleico, las imágenes y el examen histopatológico de las muestras de biopsia. Se calcula que en los lugares con recursos limitados y una elevada prevalencia de TBC e infección por VIH, el 30% de los pacientes con TBC y más de 90% de los pacientes con TBC multirresistente y ampliamente resistentes no son diagnosticados.
Una prueba nueva de diagnóstico molecular llamada Xpert MTB/RIF detecta el complejo M. tuberculosis en 2 horas, con una sensibilidad mucho mayor que la sensibilidad de la microscopia del frotis. En los pacientes infectados por el VIH, la prueba tiene una tasa de detección un 45% más elevada, comparada con el frotis. Este ensayo molecular tiene el potencial de mejorar el rendimiento de los programas nacionales de TBC y actualmente se hace en los laboratorios distritales de 67 países con una prevalencia elevada de TBC. Está disponible en Europa y pronto será aprobado en EE. UU.
Tuberculosis farmacorresistente
El estándar actual en los antibiogramas de fármacos de primera línea es un sistema automatizado de cultivo en medio líquido que tarda de 4 a 13 días en dar resultados. Los análisis moleculares con líneas de sonda que hay en el comercio pueden dar resultados en 24 horas, una vez que han sido validados con cultivo automatizados en líquido.
El ensayo Xpert MTB/RIF, en 2 horas informa sobre la resistencia a la rifampicina; esta resistencia también representa la multirresistencia de la TBC en ámbitos donde la prevalencia de resistencia medicamentosa es elevada, ya que la resistencia a la rifampicina en ausencia de resistencia a la isoniazida es infrecuente. El ensayo ha sido modificado para reducir los resultados positivos falsos con respecto a la resistencia a la rifampicina.
La OMS recomienda que para confirmar la resistencia a la rifampicina y la sensibilidad de los aislados de M. tuberculosis a otros fármacos, además del antibiograma estándar se realice el Xpert MTB/RIF. Otras pruebas de detección de la resistencia a los medicamentos son la observación microscópica (MODS) del antibiograma, el análisis de la nitrato reductasa y, los métodos colorimétricos para la reductasa.
El MODS permite detectar al mismo tiempo la presencia de M. tuberculosis, sobre la base de la formación de cordones y la resistencia a la isoniazida y la rifampicina. Como la mayoría de estos métodos no está disponible actualmente en los países donde la TBC es altamente endémica, se estima que en todo el mundo solo se diagnostica el 10% de los casos de TBC multirresistente y que solo la mitad de ellos recibe el tratamiento adecuado.
Tratamiento
Infección latente
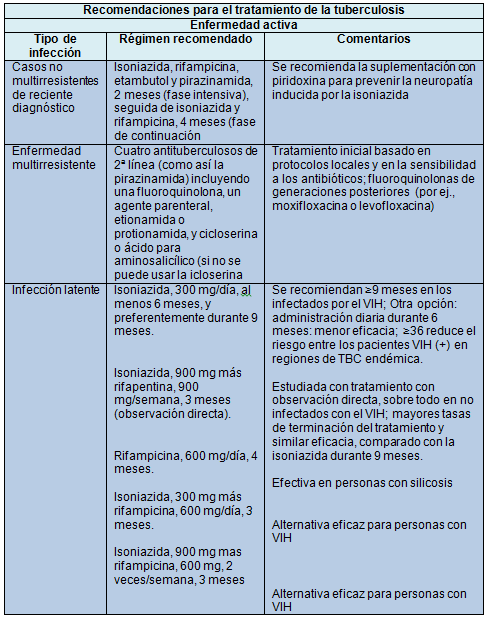
Las personas con infección por M. tuberculosis que tienen un riego mayor de TBC activa requieren tratamiento preventivo. El régimen de preferencia es la isoniazida sola durante 9 meses, o más si la persona está infectada con el VIH en zonas donde la prevalencia de TBC es elevada.
En la actualidad, en los adultos sin infección por VIH de los países con una baja carga de TBC, la administración bajo observación directa de isoniazida + rifampicina, 1 vez por semana durante 12 semanas, ha mostrado ser tan efectiva como la isoniazida sola. Este régimen se asoció con menos efectos adversos graves que el régimen de 9 meses de isoniazida sola, aunque la discontinuación del tratamiento por fenómenos adversos fue más común.
Actualmente la OMS recomienda que todas las personas infectadas con VIH o con resultados desconocidos de la prueba cutánea de tuberculina, o que no sufren TBC activa y viven en países de escasos recursos y elevada prevalencia de la enfermedad reciban tratamiento preventivo con isoniazida durante al menos 6 meses. Existen 3 regímenes efectivos para la prevención de la TBC activa en personas infectadas con VIH: isoniazida diaria durante 6-9 meses; rifampicina diaria más isoniazida durante 3 meses y, rifampicina más isoniazida, 2 veces por semana durante 3 meses.
Los regímenes con rifampicina tienen mayores tasas de toxicidad farmacológica que los que no incluyen dicho fármaco. La dificultad para diagnosticar la TBC activa en los pacientes coinfectados con VIH es responsable, en parte, de la baja prescripción de isoniazida preventiva en la práctica clínica. Solo los pacientes con una prueba cutánea de tuberculina positiva que están recibiendo tratamiento preventivo con isoniazida han disminuido las tasas de TBC activa y de muerte; la protección contra la TBC disminuye a los pocos meses de haber cesado el tratamiento con isoniazida. Un trabajo reciente realizado en Botswana mostró que 36 meses con isoniazida preventiva, comparado con los cursos terapéuticos de 6 meses, redujo la TBC subsecuente en un 43%. Sin embargo, la adherencia a este régimen fue escasa. También se investigó un régimen diario de rifapentina más isoniazida durante 1 mes.
Tratamiento de la enfermedad activa sensible a los medicamentos
El tratamiento efectivo de la TBC requiere el diagnóstico confirmado y precoz, la búsqueda de la resistencia farmacológica y del VIH, la administración de regímenes efectivos supervisados y el apoyo para la adherencia de los pacientes, a través de cursos sobre el tratamiento.
El tratamiento estándar actual de 4 fármacos de primera línea (isoniazida, rifampicina, pirazinamida y etambutol) logra tasas de curación del 95% en trabajos de investigación y del 90% en los programas de tratamiento supervisado. El tratamiento requiere un mínimo de 6 meses en 2 fases: 2 meses con los 4 fármacos (fase intensiva) y 4 meses con isoniazida y rifampicina.
Los factores de riesgo de recaída son la cavitación, la diseminación de la enfermedad, la inmunosupresión y la persistencia a las 8 semanas de la positividad del cultivo de esputo. Si cualquiera de estos factores de riesgo está presente, el tratamiento puede extenderse hasta 9 meses.
Los problemas con la terapia actual son la calidad de los fármacos, la necesidad de la administración del medicamento bajo observación directa y otros apoyos para el paciente, las interrupciones del tratamiento y los cambios de medicamentos debido a los efectos colaterales o tóxicos, interacciones farmacológicas (particularmente con la terapia antirretroviral en los pacientes coinfectados con el VIH), y los problemas de adherencia, propios de los tratamientos prolongados. Varios estudios aun no finalizados están agregando o sustituyendo por fluoroquinolonas, o probando dosis más elevadas, con el objetivo de acortar la duración del tratamiento estándar a 4 meses.
Tuberculosis y coinfección con el VIH
La TBC favorece la replicación del VIH y acelera la progresión de la infección por VIH, asociándose a mayor mortalidad. La iniciación precoz de la terapia antirretroviral reduce la mortalidad; en el grupo de pacientes con TBC que no reciben antirretrovirales, aquellos que tienen un recuento muy bajo de célulasCD4 tienen un riesgo mayor de muerte a corto plazo.
La OMS recomienda iniciar la terapia antirretroviral dentro de las 8 primeras semanas que siguen al comienzo del tratamiento antituberculoso, y que los pacientes con un recuento de células CD4 <50/mm3 reciban tratamiento antirretroviral en las 2 primeras semanas. Una excepción son los pacientes con meningitis tuberculosa en quienes el inicio precoz del tratamiento antirretroviral no mejoró los resultados y quedan en mayor riesgo de efectos adversos.
El síndrome inflamatorio de reconstitución inmunológica (SIRI) ocurre en casi en el 10% de los pacientes infectados con el VIH y que durante el tratamiento antituberculoso comienzan con terapia antiretroviral. Los casos de SIRI incluyen casos nuevos de TBC activa detectada después del comienzo del tratamiento antirretroviral (denominado SIRI enmascarado); empeora durante el tratamiento antituberculoso, luego de la iniciación del tratamiento antirretroviral (SIRI paradójico). Las manifestaciones más comunes del SIRI son la aparición de síntomas respiratorios nuevos o el empeoramiento de los ya existentes como así el aumento de las linfadenopatías. El SIRI más común en los pacientes con bajo nivel de células CD4+ y en aquellos en quienes la terapia antirretroviral fue iniciada tempranamente durante el curso del tratamiento antituberculoso.
En los pacientes con células CD4+ <50/mm3 y en los que comenzaron el tratamiento antirretroviral dentro de las 4 semanas de haber iniciado el tratamiento antituberculoso, la tasa de SIRI es casi del 50¨%. Para el tratamiento antirretroviral de los pacientes con TBC activa se prefieren los regímenes con inhibidores de la transcriptasa reversa no nucleótidos y el efavirenzs, el fármaco de primera elección.
La rifampicina reduce significativamente las concentraciones séricas de los inhibidores de la proteasa. Para evitar esta reducción se están haciendo estudios para sustituir la rifabutina por rifampicina y aumentar las dosis de los inhibidores reforzados de la proteasa. Los pacientes con TBC asociada al VIH también deben recibir trimetoprima–sulfametoxazol.
En 2 trabajos clínicos—Prevention of Early Mortality by Presumptive Tuberculosis Treatment (PROMPT) y Reducing Early Mortality and Morbidity by Empiric Tuberculosis Treatment (REMEMBER)—los investigadores evaluaron el tratamiento antituberculoso empírico precoz, con el objetivo de reducir la tasa de mortalidad en los pacientes que viven en países con TBC endémica y que tienen <50/mm3 de células CD4+ pero sin TBC probable o confirmada.
Tuberculosis multirresistente
El tratamiento de la TBC multirresistente está basado en la opinión de expertos y requiere la creación de regímenes combinados, elegidos de 5 grupos jerárquicos de fármacos de primera y segunda línea. Este tratamiento se asocia con un riesgo elevado de intolerancia y efectos tóxicos graves.
Los regímenes pueden elegirse con un criterio empírico o estandarizado y luego cambiarse a un tratamiento personalizado, basado en el antibiograma. Sin embargo, los antibiogramas no están ampliamente disponibles en las regiones en las cuales la TBC es endémica, en particular para los medicamentos de segunda línea.
Para el tratamiento de la TBC multirresistente, la OMS recomienda que la fase intensiva del tratamiento sea de al menos 8 meses. Para administrar un régimen que tenga al menos 4 fármacos de segunda línea con cierta seguridad de efectividad se debe agregar sistemáticamente una fluoroquinolona y un agente inyectable, además de la pirazinamida. En los pacientes que previamente no han recibido tratamiento de la TBC multirresistente, esta terapia debe administrarse al menos durante 20 meses.
Un estudio de observación mostró que en una población que antes no había estado expuesta a ningún medicamento de segunda línea, un régimen más corto, de 9 a 12 meses (denominado régimen de Bangladesh), tuvo una eficacia aceptable, con menos efectos adversos. Este régimen ha sido ampliamente evaluado en el estudio Standardized Treatment Regimen of Antituberculosis Drugs for Patients with Multidrug-Resistant Tuberculosis (STREAM). Debido a que la mayoría de los medicamentos recomendados tiene efectos secundarios graves, que hacen particularmente difícil del tratamiento, siempre es aconsejable consultar con un especialista en tratamiento farmacológico.
En los países con TBC endémica, la TBC ampliamente resistente es en extremo difícil de diagnosticar y tratar. Entre las personas infectadas con el VIH, las tasas de mortalidad alcanzan al 98%. Los primeros estudios sobre varios medicamentos nuevos con actividad contra la TBC multirresistente y la TBC ampliamente resistente muestran resultados prometedores y siguen en vías de investigación.
Medicamentos nuevos
Se han investigado 5 clases de medicamentos nuevos, de las cuales, 2 clases (nitroimidazoles y oxazolidinonas) y 2 fármacos (bedaquilina y SQ-109) tienen mecanismos de acción nuevos para la TBC. Los estudios en fase 2 de bedaquilina o delamanida agregadas al resto del tratamiento de la TBC multirresistente han mostrado que a las 8 semanas de tratamiento se produjo un aumento importante de la tasa de conversión de los cultivos de esputo.
Ya se han iniciado estudios en fase 3 de cada fármaco, y cada fabricante ha conseguido rápidamente las licencias para su comercialización. La Food and Drug Administration ha aprobado aceleradamente el uso de la bedaquilina para la TBC multirresistente.
Están en planeamiento o ejecución varios estudios de fármacos combinados, aunque estos trabajos se enfrentan a barreras como las interacciones farmacocinéticas, la dependencia de los resultados clínicos en lugar del uso de los puntos finales sustituidos y, el incentivo financiero relativamente bajo para que las compañías farmacéuticas lleven a cabo tales ensayos.
La evaluación eficiente de las combinaciones de fármacos nuevos requiere una estrecha cooperación entre la industria farmacéutica y los patrocinantes sin fines de lucro de los estudios clínicos. La combinación de 3 fármacos, moxifloxacina, pyrazinamida y PA-824, tiene una actividad bactericida a los 14 días similar a la del tratamiento estándar con 4 fármacos. Recientemente se ha comprobado que la lenezolida logra la conversión del cultivo de esputo en los pacientes con TBC ampliamente resistente y ya se están haciendo evaluaciones adicionales.
BCG y vacunas nuevas
En la mayoría de las regiones donde la TBC es endémica, los recién nacidos siguen recibiendo la vacuna de Calmette–Guérin (BCG) con bacilo M. bovis, Según un metaanálisis de estudios clínicos controlados, para la prevención de la TBC, la vacuna tiene una eficacia general estimada de aproximadamente 50%.
Debido a que en los inmunosuprimidos la vacuna BCG puede causar una infección diseminada fatal, no se debe vacunar a los recién nacidos infectados con el VIH. Aunque en EE. UU. esta vacuna nunca ha sido aplicada en forma sistemática, su uso es cada vez más frecuente en los adultos con test cutáneo de tuberculina negativo que están por viajar a zonas con una elevada prevalencia de TBC multirrresistente. En la actualidad se están estudiando otras opciones de inmunización.
Conclusiones
La TBC sigue siendo una causa importante de muerte en todo el mundo. El surgimiento y a propagación de la resistencia a los medicamentos y la interacción sinérgica con la epidemia de VIH plantean retos difíciles y amenazas a los esfuerzos mundiales por controlar la enfermedad.
Los diagnósticos moleculares nuevos permiten el diagnóstico preciso y precoz de la posible TBC activa. Se requieren laboratorios con experiencia y recursos para hacer estas pruebas y que estén disponibles en todo el mundo en desarrollo. Los medicamentos antituberculosos más nuevos prometen regímenes terapéuticos más cortos con fármacos sensibles y eficaces para el tratamiento de la enfermedad resistente a los medicamentos y la infección latente.
Las nuevas vacunas contra la TBC que ya están en ensayos clínicos avanzados ofrecen una esperanza para el control futuro de la TBC. Aunque estos avances científicos son prometedores, la crisis económica mundial sigue dificultando el control de la TBV.
Referencias bibliográficas
1. Global tuberculosis report 2012. Geneva: World Health Organization (http://www.who.int/tb/publications/global_report/en/).
2. Zignol M, van Gemert W, Falzon D, et al. Surveillance of anti-tuberculosis drug resistance in the world: an updated analysis, 2007-2010. Bull World Health Organ 2012;90:111D-119D
3. Tuberculosis MDR-TB and XDR-TB: 2011 progress report. Geneva: World Health Organization, 2011 (http://www.who.int/tb/challenges/mdr/factsheet_mdr_progress_march2011.pdf).
4. Hill AN, Becerra J, Castro KG. Modelling tuberculosis trends in the USA. Epidemiol Infect 2012;140:1862-1872
5. Surveillance report: tuberculosis surveillance and monitoring in Europe 2012 Geneva: World Health Organization (http://ecdc.europa.eu/en/publications/Publications/1203-Annual-TB-Report.pdf).
6. Abubakar I, Lipman M, Anderson C, Davies P, Zumla A. Tuberculosis in the UK -- time to regain control. BMJ 2011;343:d4281-d4281
7. Ewer K, Millington KA, Deeks JJ, Alvarez L, Bryant G, Lalvani A. Dynamic antigen-specific T-cell responses after point-source exposure to Mycobacterium tuberculosis. Am J Respir Crit Care Med 2006;174:831-839
8. Andrews JR, Noubary F, Walensky RP, et al. Risk of progression to active tuberculosis following reinfection with Mycobacterium tuberculosis. Clin Infect Dis 2012;54:784-791
9. Verver S, Warren RM, Beyers N, et al. Rate of reinfection tuberculosis after successful treatment is higher than rate of new tuberculosis. Am J Respir Crit Care Med 2005;171:1430-1435
10. Lahey T, Mackenzie T, Arbeit RD, et al. Recurrent tuberculosis risk among HIV-infected adults in Tanzania with prior active tuberculosis. Clin Infect Dis 2013;56:151-158
11. Frieden TR, Munsiff SS, Ahuja SD. Outcomes of multidrug-resistant tuberculosis treatment in HIV-positive patients in New York City, 1990-1997. Int J Tuberc Lung Dis 2007;11:116-116
12. Gandhi NR, Moll A, Sturm AW, et al. Extensively drug-resistant tuberculosis as a cause of death in patients co-infected with tuberculosis and HIV in a rural area of South Africa. Lancet 2006;368:1575-1580
13. Dheda K, Shean K, Zumla A, et al. Early treatment outcomes and HIV status of patients with extensively drug-resistant tuberculosis in South Africa: a retrospective cohort study. Lancet 2010;375:1798-1807
14. Udwadia ZF, Amale RA, Ajbani KK, Rodrigues C. Totally drug-resistant tuberculosis in India. Clin Infect Dis 2012;54:579-581
15. “Totally Drug-Resistant TB”: a WHO consultation on the diagnostic definition and treatment options. Geneva: World Health Organization (http://www.who.int/tb/challenges/xdr/Report_Meeting_totallydrugresistantTB_032012.pdf).
16. Nathanson E, Nunn P, Uplekar M, et al. MDR tuberculosis -- critical steps for prevention and control. N Engl J Med 2010;363:1050-1058
17. Lawn SD, Zumla AI. Tuberculosis. Lancet 2011;378:57-72
18. Caws M, Thwaites G, Dunstan S, et al. The influence of host and bacterial genotype on the development of disseminated disease with Mycobacterium tuberculosis. PLoS Pathog 2008;4:e1000034-e1000034
19. von Reyn CF. Optimal treatment of codisease due to HIV and tuberculosis. J Infect Dis 2011;204:817-819
20. von Reyn CF, Kimambo S, Mtei L, et al. Disseminated tuberculosis in human immunodeficiency virus infection: ineffective immunity, polyclonal disease and high mortality. Int J Tuberc Lung Dis 2011;15:1087-1092
21. Mudenda V, Lucas S, Shibemba A, et al. Tuberculosis and tuberculosis/HIV/AIDS-associated mortality in Africa: the urgent need to expand and invest in routine and research autopsies. J Infect Dis 2012;205:Suppl 2:S340-S346
22. Mtei L, Matee M, Herfort O, et al. High rates of clinical and subclinical tuberculosis among HIV-infected ambulatory subjects in Tanzania. Clin Infect Dis 2005;40:1500-1507
23. Cain KP, McCarthy KD, Heilig CM, et al. An algorithm for tuberculosis screening and diagnosis in people with HIV. N Engl J Med 2010;362:707-716
24. Getahun H, Kittikraisak W, Heilig CM, et al. Development of a standardized screening rule for tuberculosis in people living with HIV in resource-constrained settings: individual participant data meta-analysis of observational studies. PLoS Med 2011;8:e1000391-e1000391
25. Bates M, O'Grady J, Mwaba P, et al. Evaluation of the burden of unsuspected pulmonary tuberculosis and co-morbidity with non-communicable diseases in sputum producing adult inpatients. PLoS One 2012;7:e40774-e40774
26. Horsburgh CR Jr, Rubin EJ. Latent tuberculosis infection in the United States. N Engl J Med 2011;364:1441-1448
27. Ferrara G, Murray M, Winthrop K, et al. Risk factors associated with pulmonary tuberculosis: smoking, diabetes and anti-TNFα drugs. Curr Opin Pulm Med 2012;18:233-240
28. Updated guidelines for using interferon gamma release assays to detect Mycobacterium tuberculosis infection -- United States, 2010. MMWR Morb Mortal Wkly Rep 2010;59:1-25
29. Tuberculosis: clinical diagnosis and management of tuberculosis, and measures for its prevention and control. London: National Institute for Health and Clinical Excellence, 2011 (http://www.nice.org.uk/nicemedia/live/13422/53642/53642.pdf).
30. Use of interferon-gamma release assays in support of TB diagnosis. Stockholm: European Centre for Disease Prevention and Control, 2011 (http://ecdc.europa.eu/en/publications/Publications/1103_GUI_IGRA.pdf).
31. McNerney R, Maeurer M, Abubakar I, et al. Tuberculosis diagnostics and biomarkers: needs, challenges, recent advances, and opportunities. J Infect Dis 2012;205:Suppl 2:S147-S58
32. von Reyn CF, Horsburgh CR, Olivier KN, et al. Skin test reactions to Mycobacterium tuberculosis purified protein derivative and Mycobacterium avium sensitin among health care workers and medical students in the United States. Int J Tuberc Lung Dis 2001;5:1122-1128
33. Hopewell PC, Pai M, Maher D, Uplekar M, Raviglione MC. International standards for tuberculosis care. Lancet Infect Dis 2006;6:710-725
34. Boehme CC, Nabeta P, Hillemann D, et al. Rapid molecular detection of tuberculosis and rifampin resistance. N Engl J Med 2010;363:1005-1015
35. Lawn SD, Kerkhoff AD, Vogt M, et al. Characteristics and early outcomes of patients with Xpert MTB/RIF-negative pulmonary tuberculosis diagnosed during screening before antiretroviral therapy. Clin Infect Dis 2012;54:1071-1079
36. Policy guidance on drug-susceptibility testing (DST) of second-line antituberculosis drugs. Geneva: World Health Organization, 2008 (http://www.who.int/tb/publications/2008/whohtmtb_2008_392/en/index.html).
37. Ling DI, Zwerling AA, Pai M. GenoType MTBDR assays for the diagnosis of multidrug-resistant tuberculosis: a meta-analysis. Eur Respir J 2008;32:1165-1174
38. O'Grady J, Maeurer M, Mwaba P, et al. New and improved diagnostics for detection of drug-resistant pulmonary tuberculosis. Curr Opin Pulm Med 2011;17:134-141
39. Performance of Xpert MTB/RIF version G4 assay. Geneva: Foundation for Innovative New Diagnostics, 2011 (http://www.stoptb.org/wg/gli/assets/documents/map/findg4cartridge.pdf).
40. Rapid implementation of the Xpert MTB/RIF diagnostic test: technical and operational `how-to': practical considerations. Geneva: World Health Organization, 2011 (http://whqlibdoc.who.int/publications/2011/9789241501569_eng.pdf).
41. Moore DA, Evans CA, Gilman RH, et al. Microscopic-observation drug-susceptibility assay for the diagnosis of TB. N Engl J Med 2006;355:1539-1550
42. WHO policy on collaborative TB/HIV activities. Geneva: World Health Organization, 2012 (http://whqlibdoc.who.int/publications/2012/9789241503006_eng.pdf).
43. Martinson NA, Barnes GL, Moulton LH, et al. New regimens to prevent tuberculosis in adults with HIV infection. N Engl J Med 2011;365:11-20
44. Guidelines for intensified tuberculosis case-finding and isoniazid preventive therapy for people living with HIV in resource-constrained settings. Geneva: World Health Organization, 2011 (http://whqlibdoc.who.int/publications/2011/9789241500708_eng.pdf).
45. Sterling TR, Villarino ME, Borisov AS, et al. Three months of rifapentine and isoniazid for latent tuberculosis infection. N Engl J Med 2011;365:2155-2166
46. Akolo C, Adetifa I, Shepperd S, Volmink J. Treatment of latent tuberculosis infection in HIV infected persons. Cochrane Database Syst Rev 2010;1:CD000171-CD000171
47. Samandari T, Agizew TB, Nyirenda S, et al. 6-Month versus 36-month isoniazid preventive treatment for tuberculosis in adults with HIV infection in Botswana: a randomised, double-blind, placebo-controlled trial. Lancet 2011;377:1588-1598
48. Lawn SD, Wood R. Antiretroviral therapy for control of the HIV-associated MDR and XDR tuberculosis epidemic in South Africa. Am J Respir Crit Care Med 2010;182:1567-1567
49. Combs DL, O'Brien RJ, Geiter LJ. USPHS Tuberculosis Short-Course Chemotherapy Trial 21: effectiveness, toxicity and acceptability: the report of the final results. Ann Intern Med 1990;112:397-406
50. Abdool Karim SS, Naidoo K, Grobler A, et al. Integration of antiretroviral therapy with tuberculosis treatment. N Engl J Med 2011;365:1492-1501
51. Havlir DV, Kendall MA, Ive P, et al. Timing of antiretroviral therapy for HIV-1 infection and tuberculosis. N Engl J Med 2011;365:1482-1491
52. Blanc FX, Sok T, Laureillard D, et al. Earlier versus later start of antiretroviral therapy in HIV-infected adults with tuberculosis. N Engl J Med 2011;365:1471-1481
53. Naidoo K, Yende-Zuma N, Padayatchi N, et al. The immune reconstitution inflammatory syndrome after antiretroviral therapy initiation in patients with tuberculosis: findings from the SAPiT trial. Ann Intern Med 2012;157:313-324
54. Swaminathan S, Padmapriyadarsini C, Venkatesan P, et al. Efficacy and safety of once-daily nevirapine- or efavirenz-based antiretroviral therapy in HIV-associated tuberculosis: a randomized clinical trial. Clin Infect Dis 2011;53:716-724
55. ClinicalTrials.gov. Rifampin-based tuberculosis treatment versus rifabutin-based tuberculosis treatment in HIV (http://clinicaltrials.gov/ct2/show/NCT01601626).
56. Idem. Prevention of Early Mortality by Presumptive Tuberculosis (TB) Treatment (PrOMPT) (http://clinicaltrials.gov/ct2/show/NCT01417988).
57. Idem. REMEMBER: Reducing Early Mortality & Morbidity by Empiric Tuberculosis (TB) Treatment (http://clinicaltrials.gov/ct2/show/NCT01380080).
58. Guidelines for the programmatic management of drug resistant tuberculosis. Geneva: World Health Organization, 2011 (http://whqlibdoc.who.int/publications/2011/9789241501583_eng.pdf).
59. Falzon D, Jaramillo E, Schunemann HJ, et al. WHO guidelines for the programmatic management of drug-resistant tuberculosis: 2011 update. Eur Respir J 2011;38:516-528
60. Van Deun A, Salim MA, Das AP, Bastian I, Portaels F. Results of a standardised regimen for multidrug-resistant tuberculosis in Bangladesh. Int J Tuberc Lung Dis 2004;8:560-567
61. STREAM: the evaluation of a standardised treatment regimen of anti-tuberculosis drugs for patients with multi-drug-resistant tuberculosis (MDR-TB). 2011 (http://www.controlled-trials.com/isrctn/pf/78372190).
62. Ahuja SD, Ashkin D, Avendano M, et al. Multidrug resistant pulmonary tuberculosis treatment regimens and patient outcomes: an individual patient data meta-analysis of 9,153 patients. PLoS Med 2012;9:e1001300-e1001300
63. Jacobson KR, Tierney DB, Jeon CY, Mitnick CD, Murray MB. Treatment outcomes among patients with extensively drug-resistant tuberculosis: systematic review and meta-analysis. Clin Infect Dis 2010;51:6-14
64. Diacon AH, Pym A, Grobusch M, et al. The diarylquinoline TMC207 for multidrug-resistant tuberculosis. N Engl J Med 2009;360:2397-2405
65. Gler MT, Skripconoka V, Sanchez-Garavito E, et al. Delamanid for multidrug-resistant pulmonary tuberculosis. N Engl J Med 2012;366:2151-2160
66. Diacon AH, Dawson R, von Groote-Bidlingmaier F, et al. 14-Day bactericidal activity of PA-824, bedaquiline, pyrazinamide, and moxifloxacin combinations: a randomised trial. Lancet 2012;380:986-993
67. Lee M, Lee J, Carroll MW, et al. Linezolid for treatment of chronic extensively drug-resistant tuberculosis. N Engl J Med 2012;367:1508-1518
68. Colditz GA, Brewer TF, Berkey CS, et al. Efficacy of BCG vaccine in the prevention of tuberculosis: meta-analysis of the published literature. JAMA 1994;271:698-702
69. Stop TB Partnership. Tuberculosis vaccine candidates — 2011 (http://www.stoptb.org/wg/new_vaccines/assets/documents/TB%20Vaccine%20Pipeline_rAug%202012.pdf).
70. von Reyn CF, Mtei L, Arbeit RD, et al. Prevention of tuberculosis in Bacille Calmette-Guérin-primed, HIV-infected adults boosted with an inactivated whole-cell mycobacterial vaccine. AIDS 2010;24:675-685
71. Raviglione M, Marais B, Floyd K, et al. Scaling up interventions to achieve global tuberculosis control: progress and new developments. Lancet 2012;379:1902-1913[Erratum, Lancet 2012;379:2242.]
|


No hay comentarios:
Publicar un comentario