Actualización: La tuberculosis sigue siendo una causa importante, pero frecuentemente no reconocida, de enfermedad y muerte en los niños de zonas donde la enfermedad es endémica.
Autor(es): Dres. Carlos M. Pérez-Vélez - Ben J. Marais
Enlace: N Engl J Med 2012; 367: 348-61
Resumen
|
Introducción
La implementación generalizada de la estrategia de tratamiento breve bajo observación directa (conocida como DOTS) durante la década de 1990 dio lugar a un mejor control global de la tuberculosis. Sin embargo, su eficacia ha sido limitada en las áreas donde prevalecen la pobreza y la infección con el virus de la inmunodeficiencia humana (VIH) o la tuberculosis resistente a los fármacos, y el énfasis en una baciloscopía positiva como criterio diagnóstico actualmente excluye de la atención a la mayoría de los niños.
La tuberculosis sigue siendo una causa importante, pero frecuentemente no reconocida, de enfermedad y muerte en los niños de zonas donde la enfermedad es endémica; la prestación de servicios en esas zonas se ve obstaculizada por la ausencia de estrategias pragmáticas para guiar su diagnóstico y manejo. Este artículo proporciona una breve descripción de los principios básicos, las controversias actuales, y los recientes avances relacionados con el cuidado de los niños con tuberculosis, con énfasis en la enfermedad intratorácica.
Carga de enfermedad y cambios epidemiológicos recientes
La pobre determinación y notificación de los casos de tuberculosis dificulta la estimación precisa de la carga global de enfermedad en los niños. Entre los 4.452.860 nuevos casos reportados en el 2010 por los 22 países con mayor carga de enfermedad por tuberculosis, sólo 157.135, o el 3,5% (rango 0,1 a 15), se produjeron en niños. Las mejores estimaciones sugieren que los niños (definidos como personas menores de 15 años de edad) representan aproximadamente el 11% de la carga de enfermedad por tuberculosis, lo que sugiere que algo más de 332.000 casos de tuberculosis infantil no fueron diagnosticados o declarados en estos países.
A pesar de que el sobrediagnóstico puede ocurrir, el subdiagnóstico es la regla en la mayoría de las zonas donde hay una alta carga de enfermedad y donde los niños con tuberculosis pueden tener acceso a los servicios sólo a través de los hospitales de referencia.
El problema de la falta de diagnóstico en los niños es ilustrado por el bajo número de casos pediátricos reportados en cuatro países con una alta carga de enfermedad, donde se esperarían tasas superiores al 10% de todos los casos reportados: Rusia, 0,8%, India, 1,1%, Nigeria, 1,4%, y Brasil, 3.5%. En áreas como América del Norte y Europa Occidental, donde existe una mínima transmisión interna y un suministro rutinario de profilaxis post-exposición, se ve afectada una menor proporción de niños, y la mayoría de los casos de tuberculosis infantil ocurren en poblaciones inmigrantes.
La coinfección con el VIH ha tenido un importante efecto epidemiológico, especialmente en el África subsahariana. Aparte de que lleva a un aumento en el número absoluto de pacientes con tuberculosis, ha inducido un cambio marcado en la edad y el sexo de los pacientes hacia las mujeres jóvenes en edad fértil. El efecto de este cambio demográfico puede observarse en los altos índices de exposición a la tuberculosis entre los niños nacidos de madres infectadas por el VIH y en las altas tasas de tuberculosis entre los lactantes infectados por el virus. El inicio temprano de la terapia antirretroviral es la intervención más importante para la reducción de la mortalidad global y del riesgo de tuberculosis entre los niños infectados por el VIH, proporcionando el tratamiento preventivo con isoniazida un beneficio adicional.
La aparición de la tuberculosis fármaco-resistente plantea una gran amenaza para el control mundial de esta enfermedad. La complacencia inicial para abordar el problema fue influenciada por estudios que indicaban que la adquisición de resistencia a la isoniazida reducía la patogenicidad de la cepa. Sin embargo, el desarrollo de tuberculosis multirresistente (que se caracteriza por la resistencia a isoniazida y rifampicina) en los niños expuestos a personas con tuberculosis fármaco-resistente, así como su diseminación clonal en los sistemas penitenciarios de Nueva York y Rusia, han proporcionado evidencia clínica de la transmisibilidad de las cepas multirresistentes.
Una prueba adicional fue proporcionada por un brote explosivo y amplio de tuberculosis fármaco-resistente (bacterias multirresistentes con resistencia adicional a fluoroquinolonas y a un agente inyectable de segunda línea) en pacientes con infección por el VIH en el sur de África. Aunque la incidencia de la tuberculosis fármaco-resistente en los niños es desconocida, los casos pediátricos proporcionan un valioso punto de vista epidemiológico, ya que reflejan la transmisión constante dentro de las comunidades.
En los lugares donde las tasas de tuberculosis fármaco-resistente en niños han sido controladas, las tasas entre los mismos fueron similares a las de los adultos de la misma comunidad. La Organización Mundial de la Salud (OMS) estimó que en 2008, 3,6% de los casos incidentes de tuberculosis a nivel mundial eran de tipo multirresistente o extensivamente resistentes a los fármacos, lo que sugiere que hubo una carga similar de este tipo de enfermedad entre los niños.
Historia natural de la enfermedad
Se requiere la comprensión de la historia natural de la tuberculosis para apreciar tanto las variaciones en la susceptibilidad a la enfermedad como el amplio espectro de manifestaciones clínicas observadas en los niños. Las descripciones minuciosas de la tuberculosis en la literatura publicada antes de la introducción de la quimioterapia proporcionan información valiosa sobre la secuencia de eventos que sigue a la infección primaria con Mycobacterium tuberculosis (tabla 1). Una observación importante documentada en estos estudios previos fue la presencia de adenopatías hiliares transitorias, e incluso la excreción de M. tuberculosis, en niños que nunca habían tenido progresión a enfermedad. Este hecho plantea un problema importante en la definición de caso para los estudios, por ejemplo, los de eficacia de vacunas, que utilizan estrategias activas de hallazgo de casos en poblaciones de niños asintomáticos que han sido expuestos a personas con enfermedades infecciosas. La formulación reciente de un consenso internacional sobre normas de referencia y metodología uniforme de la investigación debería facilitar el progreso.
La secuencia de acontecimientos que sigue a la reinfección (que es común en las zonas donde la tuberculosis es endémica) permanece pobremente definida. En los casos de tuberculosis recurrente, la tipificación de la cepa permite diferenciar la recaída de la reinfección, pero no puede ser utilizada para cuantificar el riesgo de reinfección. El análisis de datos compuestos sugiere que existe una reducción del 79% en el riesgo de progresión de la enfermedad entre adultos inmunocompetentes previamente infectados en comparación con adultos no infectados anteriormente después de la documentación de exposición; sin embargo, la contribución epidémica hecha por la reinfección depende de la frecuencia de su ocurrencia en un medio ambiente en particular.
Es importante diferenciar la infección de la enfermedad, ya que la infección es un evento común y los enfoques para el manejo de las dos condiciones son muy diferentes. La progresión de la enfermedad suele manifestarse por síntomas persistentes, que no remiten, aunque la tasa de progresión es variable. En la gran mayoría de los casos (> 90%), la enfermedad se produce en el plazo de 1 año después de la infección primaria, teniendo los niños más pequeños un mayor riesgo de progresión. El perfil de riesgo es bimodal, con los adolescentes presentando un mayor riesgo. La exploración de los mecanismos subyacentes al aumento del riesgo y al cambio repentino en el fenotipo hacia la enfermedad cavitaria de tipo adulto que ocurre con el inicio de la pubertad debería proporcionar nuevos conocimientos sobre la inmunopatogénesis de la tuberculosis.
Métodos de diagnóstico
Los niños suelen ser evaluados para tuberculosis después de presentar signos o síntomas sugestivos de enfermedad (hallazgo pasivo de casos) o como resultado de la investigación de contactos o de detección de rutina ante inmigración (búsqueda activa de casos). La presentación clínica de los niños cuya infección es detectada a través de la búsqueda activa de casos difiere de la de niños cuya infección se detecta de forma pasiva, teniendo el primer grupo a menudo infección pero no enfermedad o teniendo enfermedad en una fase muy temprana. Entre los niños en los que se detecta infección por M. tuberculosis, los niños pequeños y aquellos con exposición reciente se encuentran en mayor riesgo de progresión de la enfermedad. El conocimiento de la situación del niño respecto a la probabilidad de exposición cambia la probabilidad pre-prueba de la enfermedad y el valor predictivo positivo de las investigaciones subsecuentes.
Tabla 1. Síndromes clínicos asociados con Tuberculosis en niños* (Ver Tabla IntraMed)
Evaluación Clínica
Tener una historia clínica detallada del paciente es esencial para explorar la naturaleza de la exposición y para caracterizar los síntomas con precisión. La diversidad de la presentación clínica y la naturaleza no específica de la mayoría de los síntomas complican el diagnóstico. Los síntomas constitucionales a menudo incluyen retraso del crecimiento (desviación con respecto a la trayectoria esperada de la curva de crecimiento) y apatía; se observa menos frecuentemente fiebre intermitente o de bajo grado.
Con el compromiso de las vías respiratorias, el síntoma habitual de presentación es la tos o agitación persistente, que no remite y que no responde al tratamiento para posibles causas alternativas. Los signos clínicos son a menudo sutiles, y no se ha validado adecuadamente ningún sistema de puntuación diagnóstica; la sensibilidad y especificidad de los métodos de diagnóstico clínico para la tuberculosis son particularmente deficientes en los niños con infección por VIH.
Estudios por imágenes
En la práctica clínica, la radiografía de tórax es uno de los estudios diagnósticos más útiles. Debe obtenerse tanto una vista frontal como lateral, ya que la vista lateral ayuda en la evaluación del mediastino y las áreas hiliares. Los hallazgos radiográficos varían, pero la presencia de adenopatía hiliar pronunciada, con o sin compresión de las vías respiratorias, es altamente sugestiva de tuberculosis. La Unión Internacional contra la Tuberculosis y las Enfermedades Respiratorias recopiló en un atlas casos ilustrativos. Desafortunadamente, la calidad técnica de las radiografías obtenidas en las zonas donde la tuberculosis es endémica es a menudo pobre, o no cuentan con la disponibilidad para realizarlas.
La ecografía es útil para confirmar la presencia de derrame pericárdico o pleural y de linfadenopatías abdominales. La tomografía computarizada (TC) de alta resolución ofrece una excelente visualización anatómica, pero debido a su alto costo y al alto nivel de radiación al que se expone al paciente, en comparación con otros estudios por imágenes, debe reservarse para los casos complicados. Tanto la TC como la resonancia magnética nuclear (RMN) son particularmente útiles en la visualización de los efectos intracraneales de la enfermedad, aunque la RMN es más sensible a la detección de lesiones del tronco cerebral y de defectos de perfusión tempranos en pacientes con meningitis tuberculosa, y también permite una mejor evaluación de la columna vertebral y de los tejidos blandos.
Estudios de laboratorio
La Tabla 2 proporciona una visión general de los exámenes de laboratorio utilizados en el diagnóstico de la tuberculosis. El examen microscópico de las muestras de esputo es la piedra angular del diagnóstico en la mayoría de los países, pero su utilidad es limitada en niños pequeños con enfermedad paucibacilar que no son capaces de expectorar. Tanto la prueba cutánea de la tuberculina como la de liberación de interferón-γ fallan en diferenciar la infección por M. tuberculosis de la enfermedad activa. La OMS recomienda que el estudio con interferón no sea utilizado en lugar de la prueba cutánea de tuberculina, aunque las dos pruebas pueden ser complementarias, mejorando la sensibilidad o especificidad de la evaluación en circunstancias clínicas específicas.
La recolección de muestras de esputo producidas de forma espontánea en los niños pequeños es problemática; la inducción del esputo y la aspiración gástrica (con o sin aspiración laringofaríngea) son métodos alternativos factibles de recolección. La "prueba del hilo" (que implica el uso de un hilo de nylon esofagogastroduodenal que puede absorber el esputo ingerido) funciona bien en adultos con infección por VIH que tienen poca expectoración, y los resultados preliminares de las pruebas en niños parecen promisorios. La biopsia por aspiración con aguja fina es muy útil en los niños con una masa ganglionar periférica.
Tabla 2. Estudios diagnósticos para tuberculosis en niños* (Ver Tabla IntraMed)
Aunque el ensayo Xpert-MTB/RIF es menos sensible que los cultivos líquidos para la detección de M. tuberculosis en niños y adultos, proporciona resultados rápidamente, es altamente específico, y detecta resistencia a la rifampicina.
Cuando se utilizan dos muestras de esputo, el ensayo detecta tres veces más casos que cuando se utiliza la microscopía, pero sólo cerca del 70% de los casos cuando se utiliza cultivo líquido. Actualmente, el acceso al ensayo Xpert-MTB/RIF es limitado.
Cada uno de los enfoques diagnósticos descriptos tiene limitaciones. Sin embargo, cuando una combinación de hallazgos clínicos, radiológicos, de laboratorio e histopatológicos es consistente con un diagnóstico de tuberculosis y existe evidencia epidemiológica de exposición o evidencia inmunológica de infección por M. tuberculosis, es posible el diagnóstico preciso en la mayoría de los casos.
Principios del manejo de la enfermedad
Aunque todos los esfuerzos deben dirigirse a alcanzar la confirmación bacteriológica de la enfermedad, las tasas de confirmación siguen siendo bajas, y el inicio del tratamiento no debe demorarse en niños inmunológicamente vulnerables. Desafortunadamente, algunos programas de control de tuberculosis no inician el tratamiento sin la confirmación bacteriológica, citando el riesgo de eventos adversos por el tratamiento y las preocupaciones acerca de la amplificación de la resistencia a los fármacos. Sin embargo, los eventos adversos son poco frecuentes en los niños pequeños que son tratados con drogas antituberculosas de primera línea, y éstos presentan bajo riesgo de contraer o transmitir tuberculosis fármaco-resistente.
A pesar de las diferencias entre la tuberculosis de adultos y pacientes pediátricos, los principios del manejo de la enfermedad son similares. El propósito del tratamiento antituberculoso es curar al paciente individual, mientras que la intención de los esfuerzos de la salud pública es poner fin a la transmisión y prevenir la aparición de resistencia a los fármacos. Los bacilos son rápidamente eliminados por los agentes bactericidas con alta actividad, terminando así con la transmisión, mejorando los síntomas, y disminuyendo el riesgo de resistencia a las drogas (mediante la reducción de la población de la que surgen mutantes resistentes a los fármacos). Es necesario el uso de fármacos con actividad de esterilización para erradicar las subpoblaciones persistentes de bacilos con metabolismo intermitente, previniendo de esta forma las recaídas y efectuando una curación a largo plazo. La clasificación pragmática de la enfermedad debe guiar el manejo de los casos (figura 1).
Las variables más importantes a considerar en el manejo de la enfermedad son la carga bacilar y la ubicación anatómica. La resistencia a los fármacos debe ser considerada en los niños de zonas con alta prevalencia de tuberculosis fármaco-resistente y en los que han tenido contacto documentado con una persona con tuberculosis fármaco-resistente, con alguien que falleció durante el tratamiento o que no se adhiere a la terapia, o con personas bajo retratamiento por tuberculosis.
Los niños pequeños con enfermedad no complicada que provienen de zonas con baja prevalencia de resistencia a isoniazida pueden ser tratados con tres fármacos (isoniazida, rifampicina y pirazinamida) durante los 2 meses de la fase intensiva de tratamiento, seguido de isoniazida y rifampicina durante los 4 meses de la fase de continuación. Sin embargo, los niños con enfermedad pulmonar extensa o cavitaria (que sugieren una alta carga bacilar) o que provienen de áreas con una alta prevalencia de resistencia a la isoniazida deben recibir un cuarto fármaco (etambutol, que es seguro en niños de todas las edades) durante los 2 meses de la fase intensiva de tratamiento.
En ausencia de resistencia a los fármacos, la causa más frecuente de pobre respuesta al tratamiento es la falta de adherencia al régimen. Aunque la evidencia empírica del valor del DOT es limitada, como método de administración de medicamentos, es preferible a la administración sin supervisión y a la administración por un familiar. En la mayoría de los casos, la recurrencia de la tuberculosis más de 12 meses después de finalizado el tratamiento representa una nueva infección.
El tratamiento de primera línea estándar es apropiado en ausencia de exposición a una persona que se cree que tiene tuberculosis fármaco-resistente. El uso de un régimen de retratamiento escalado que incluya estreptomicina es resistido. Cuando existe una mala respuesta clínica en un paciente con historia de adherencia al tratamiento, debe llevarse a cabo una reevaluación del diagnóstico, incluyendo la consideración del síndrome inflamatorio de reconstitución inmune (SIRI) y la resistencia a fármacos. Los principios para el manejo de la tuberculosis fármaco-resistente en los niños se han resumido en otras partes, y se han reportado sus excelentes resultados.
Figura 1: Algoritmo para el diagnóstico y clasificación de la tuberculosis en niños
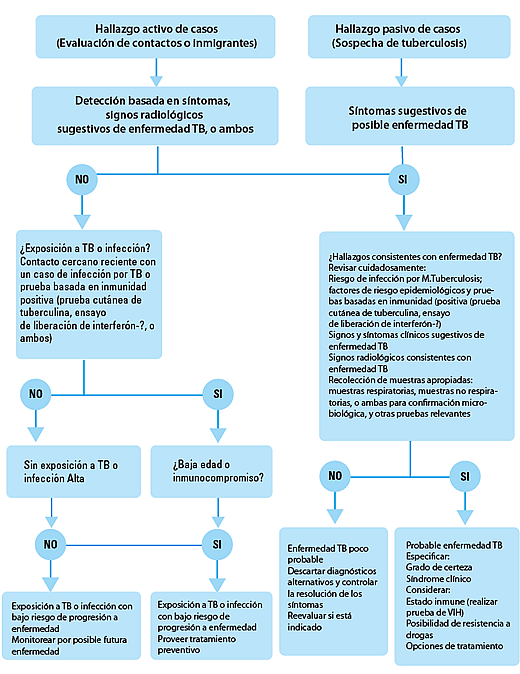
La recuperación inmunológica después del inicio del tratamiento antirretroviral en individuos coinfectados con VIH o de la rehabilitación nutricional puede desenmascarar una enfermedad subclínica o inducir un deterioro paradójico, a pesar del tratamiento adecuado para la tuberculosis. El hallazgo de SIRI no indica fracaso del tratamiento, y el mismo no debe interrumpirse; los pacientes con SIRI severo pueden requerir un curso de glucocorticoides. A pesar del riesgo de SIRI, los datos en adultos indican que la terapia antirretroviral es más eficaz cuando se inicia dentro de las 8 semanas después de comenzar el tratamiento de la tuberculosis, o en pacientes con un sistema inmunológico gravemente comprometido, dentro de las 2 a 4 semanas después del inicio del tratamiento. La única excepción serían los pacientes con tuberculosis del sistema nervioso central, en el que el SIRI puede tener consecuencias devastadoras. En la tuberculosis asociada al VIH, el tratamiento debe ser administrado a diario, y puede llegar a necesitarse un curso prolongado, dependiendo del grado de compromiso del sistema inmune del paciente y de la extensión de la enfermedad.
Prevención y control
La transmisión de la tuberculosis dentro de las instalaciones de atención de la salud es una preocupación particular en los lugares donde los niños vulnerables inmunológicamente pueden estar expuestos. En los hospitales y clínicas, debe darse especial consideración a las áreas donde se tratan a los pacientes y a los patrones de intercambio de aire. También es importante reconocer que los padres o cuidadores sintomáticos pueden plantear un riesgo de transmisión. La vacunación con el bacilo de Calmette-Guérin (BCG) reduce el riesgo de enfermedad diseminada (miliar) y de meningitis tuberculosa en los niños pequeños, pero no ofrece protección constante contra la tuberculosis de tipo adulto.
No se han establecido beneficios de la vacuna BCG en niños infectados con VIH, y está contraindicada en estos pacientes, debido al riesgo de enfermedad BCG diseminada. El desarrollo de una vacuna segura y eficaz sigue siendo una de las principales prioridades entre los investigadores de la salud a nivel mundial. Con una buena adherencia, un curso de 6 meses de tratamiento preventivo con isoniazida proporciona una excelente protección contra la enfermedad tuberculosa. A pesar de las recomendaciones universales sobre la provisión de terapia preventiva y la fuerte evidencia del riesgo mucho mayor de tuberculosis y el aumento de la mortalidad entre los niños con contacto cercano con personas que tienen tuberculosis, la aplicación de estrategias preventivas sigue siendo pobre.
Se requieren soluciones pragmáticas para cerrar la pronunciada brecha entre la política y la práctica. Los padres a menudo son reacios a administrar un tratamiento preventivo para un niño por lo demás sano, y la larga duración de la terapia preventiva es una fuente de desánimo más. Un estudio mostró que un curso de 3 meses de tratamiento preventivo con isoniazida y rifampicina fue similar en eficacia a un curso de 9 meses de isoniazida sola.
Un régimen de 12 dosis de rifapentina e isoniazida semanal ha demostrado ser eficaz en adultos, pero este régimen todavía no se recomienda para niños menores de 12 años de edad ya que se requieren datos específicos sobre seguridad y eficacia en este grupo etario. La eficacia de los regímenes abreviados no ha sido bien estudiada en niños con infección por VIH. Una desventaja de los regímenes que incluyen rifampicina o rifapentina es la interacción de estos fármacos con los inhibidores de la proteasa incluidos en el tratamiento antirretroviral proporcionado para la infección por HIV; la rifabutina es menos reactiva, pero no ha sido evaluado su uso en los regímenes de tratamiento preventivo.
Aunque el valor de la profilaxis post-exposición es universalmente reconocido, el valor de la profilaxis pre-exposición sigue en duda. Los sucesivos estudios controlados aleatorios de profilaxis pre-exposición en niños con infección por VIH han tenido resultados contradictorios. El primero de estos estudios, que incluyó a niños con mínimo acceso a la terapia antirretroviral, se suspendió debido a una mayor mortalidad en el grupo placebo. La reducción de la mortalidad entre los que recibieron terapia preventiva con isoniazida se limitó a los primeros 2 a 3 meses de tratamiento, aumentando la posibilidad de que la tuberculosis subclínica estuviera presente al ingreso en el estudio. El segundo ensayo incluyó niños pequeños (de 3 a 4 meses de edad) que habían estado expuestos al VIH, pero que no tenían exposición conocida a tuberculosis.
Los lactantes fueron asignados aleatoriamente para recibir isoniazida de etiqueta abierta o placebo; los que estaban infectados con VIH también recibieron tratamiento antirretroviral temprano. Todos los niños fueron monitoreados de cerca para evaluar una posible exposición posterior a la tuberculosis. Los investigadores no hallaron ninguna diferencia significativa en la incidencia de tuberculosis o de mortalidad entre los grupos de tratamiento y placebo, lo que sugiere que la profilaxis pre-exposición contra la tuberculosis tiene poco valor si los lactantes infectados por el VIH son enrolados en programas de manejo temprano, con meticulosa vigilancia de la exposición a la tuberculosis y la provisión de profilaxis post-exposición. Sin embargo, el valor de la profilaxis pre-exposición en áreas donde el monitoreo de la exposición a la tuberculosis es probable que sea pobre permanece sin resolverse.
Con el uso del tratamiento preventivo con isoniazida después de la finalización del tratamiento de la tuberculosis en adultos infectados por VIH, se ha estimado que pueden prevenirse 83 recurrencias por cada 1000 casos tratados. La OMS recomienda la terapia preventiva con isoniazida por 6 a 36 meses después de la finalización del tratamiento de la tuberculosis en todos los pacientes con infección por VIH, incluyendo a los niños que viven en zonas con una alta prevalencia de tuberculosis. Sin embargo, el valor agregado del tratamiento preventivo en comparación con las estrategias en curso de detección de la exposición a tuberculosis y la meticulosa profilaxis post-exposición no ha sido evaluado.
Es posible reducir drásticamente la morbilidad y la mortalidad asociadas a la tuberculosis pediátrica si se mejora la detección de casos y si los tratamientos preventivos y curativos se vuelven más accesibles a nivel mundial. Muchos de los retos siguen siendo prioridades de investigación, pero mientras se espera el desarrollo de nuevas vacunas, mejores diagnósticos, y regímenes de tratamiento más cortos, puede lograrse mucho más con los enfoques pragmáticos y la aplicación sensible de las herramientas existentes.
Comentario: La tuberculosis es una enfermedad que continúa siendo endémica en muchos países, con altas tasas de morbilidad y mortalidad principalmente en niños y en pacientes inmunocomprometidos. Debido a que en muchos casos los signos y síntomas de enfermedad pueden ser sutiles, se requiere de un alto nivel de sospecha y de una adecuada anamnesis para evaluar el contacto cercano con personas infectadas con el bacilo. Además de la instauración del tratamiento adecuado, resulta fundamental implementar políticas de salud adecuadas para mejorar la detección de casos, permitir el acceso de la población al tratamiento pre y post-exposición, y disminuir la resistencia a los fármacos mediante el cumplimiento de la terapéutica adecuada.
Referencias bibliográficas
1. Global tuberculosis control report 2011. Geneva: World Health Organization, 2011 (WHO/HTM/TB/2011.16).
2. Marais BJ, Raviglione M, Donald PR, et al. Scale-up of services and research priorities for diagnosis, management and control of tuberculosis: a call to action. Lancet 2010;375:2179-2191
3. Marais BJ, Gupta A, Starke JR, El Sony A. Tuberculosis in women and children. Lancet 2010;375:2057-2059
4. Newton SM, Brent AJ, Anderson S, Whittaker E, Kampmann B. Paediatric tuberculosis. Lancet Infect Dis 2008;8:498-510
5. Nelson LJ, Wells CD. Global epidemiology of childhood tuberculosis. Int J Tuberc Lung Dis 2004;8:636-647
6. Menzies HJ, Winston CA, Holtz TH, Cain KP, Mac Kenzie WR. Epidemiology of tuberculosis among US- and foreign-born children and adolescents in the United States, 1994-2007. Am J Public Health 2010;100:1724-1729
7. Sandgren A, Hollo V, Quinten C, Manissero D. Childhood tuberculosis in the European Union/European Economic area, 2000 to 2009. Euro Surveill 2011;16:pii:19825-19825
Medline
8. Lawn SD, Bekker LG, Middelkoop K, Myer L, Wood R. Impact of HIV infection on the epidemiology of tuberculosis in a peri-urban community in South Africa: the need for age-specific interventions. Clin Infect Dis 2006;42:1040-1047
9. Cotton MF, Schaaf HS, Lottering G, Wever HL, Coetzee J, Nachman S. Tuberculosis exposure in HIV-exposed infants in a high-prevalence setting. Int J Tuberc Lung Dis 2008;12:225-227
10. Hesseling AC, Cotton MF, Jennings T, et al. High incidence of tuberculosis among HIV-infected infants: evidence from a South African population-based study highlights the need for improved tuberculosis control strategies. Clin Infect Dis 2009;48:108-114
11. Violari A, Cotton MF, Gibb DM, et al. Early antiretroviral therapy and mortality among HIV-infected infants. N Engl J Med 2008;359:2233-2244
12. Guidelines for intensified TB case-finding and INH preventive therapy for people living with HIV in resource-constrained settings: annexes. Geneva: World Health Organization, 2011 (http://whqlibdoc.who.int/publications/2011/9789241500708_annexes_eng.pdf).
13. Multidrug and extensively drug-resistant TB (M/XDR-TB): 2010 Global report on surveillance and response. Geneva: World Health Organization, 2010 (WHO/HTM/TB/2010.3).
14. Middlebrook G, Cohn ML. Some observations on the pathogenicity of isoniazid-resistant variants of tubercle bacilli. Science 1953;118:297-299
15. Schaaf HS, Marais BJ, Hesseling AC, Gie RP, Beyers N, Donald PR. Childhood drug-resistant tuberculosis in the Western Cape Province of South Africa. Acta Paediatr 2006;95:523-528
16. Moss AR, Alland D, Telzak E, et al. A city-wide outbreak of a multiple-drug-resistant strain of Mycobacterium tuberculosis in New York. Int J Tuberc Lung Dis 1997;1:115-121
17. Drobniewski F, Balabanova Y, Nikolayevsky V, et al. Drug-resistant tuberculosis, clinical virulence, and the dominance of the Beijing strain family in Russia. JAMA 2005;293:2726-2731
18. Gandhi NR, Moll A, Sturm AW, et al. Extensively drug-resistant tuberculosis as a cause of death in patients co-infected with tuberculosis and HIV in a rural area of South Africa. Lancet 2006;368:1575-1580
19. Wallgren A. The time-table of tuberculosis. Tubercle 1948;29:245-251
20. Lincoln EM, Sewell EM. Tuberculosis in children. New York: McGraw-Hill, 1963:1-315.
21. Marais BJ, Gie RP, Schaaf HS, et al. The natural history of childhood intra-thoracic tuberculosis: a critical review of the pre-chemotherapy literature. Int J Tuberc Lung Dis 2004;8:392-402
22. Hatherill M, Hanslo M, Hawkridge T, et al. Structured approaches for the screening and diagnosis of tuberculosis in a high prevalence region of South Africa. Bull World Health Organ 2010;88:312-320
23. Hatherill M, Verver S, Mahomed H. Consensus statement on diagnostic end points for infant tuberculosis vaccine trials. Clin Infect Dis 2012;54:493-501
24. Graham SM, Ahmed T, Amanullah F, et al. Evaluation of tuberculosis diagnostics in children: 1. Proposed clinical case definitions for classification of intrathoracic tuberculosis disease: consensus from an expert panel. J Infect Dis 2012;205:Suppl 2:S199-S208
25. Cuevas LE, Browning R, Bossuyt P, et al. Evaluation of tuberculosis diagnostics in children: 2. Methodological issues for conducting and reporting research evaluations of tuberculosis diagnostics for intrathoracic tuberculosis in children: consensus from an expert panel. J Infect Dis 2012;205:Suppl 2:S209-S215
26. Andrews JR, Noubary F, Walensky RP, et al. Risk of progression to active tuberculosis following reinfection with mycobacterium tuberculosis. Clin Infect Dis 2012;54:784-791
27. Donald PR, Marais BJ, Barry CE III. The influence of age on the epidemiology and pathology of tuberculosis. Lancet 2010;375:1852-1854
28. Marais BJ, Gie RP, Hesseling AC, et al. A refined symptom-based approach to diagnose pulmonary tuberculosis in children. Pediatrics 2006;118:e1350-e1359
29. Hesseling AC, Schaaf HS, Gie RP, Starke JR, Beyers N. A critical review of diagnostic approaches used in the diagnosis of childhood tuberculosis. Int J Tuberc Lung Dis 2002;6:1038-1045
30. Edwards DJ, Kitelele F, van Rie A. Agreement between clinical scoring systems used for the diagnosis of tuberculosis in the HIV era. Int J Tuberc Lung Dis 2007;11:263-269
31. Gie RP. Diagnostic atlas of intrathoracic tuberculosis in children: a guide for low income countries. Paris: International Union Against Tuberculosis and Lung Disease, 2003.
32. Andronikou S, van Hoenacker FM, de Backer AI. Advances in imaging chest tuberculosis: blurring-of-differences-between-children-and-adults. Clin Chest Med 2009;30:717-744
33. Pienaar M, Andronikou S, van Toorn R. MRI to demonstrate diagnostic features and complications of TBM not seen with CT. Childs Nerv Syst 2009;25:941-947
34. Use of tuberculosis interferon-gamma release assays (IGRAs) in low- and middle-income countries: policy statement. Geneva: World Health Organization, 2011.
35. Updated guidelines for using interferon gamma release assays to detect Mycobacterium tuberculosis infection -- United States, 2010. MMWR Recomm Rep 2010;59:1-25
36. Nicol MP, Zar HJ. New specimens and laboratory diagnostics for childhood pulmonary TB: progress and prospects. Paediatr Respir Rev 2011;12:16-21
37. Vargas D, Garcia L, Gilman RH, et al. Diagnosis of sputum-scarce HIV-associated pulmonary tuberculosis in Lima, Peru. Lancet 2005;365:150-152
38. Perez-Velez CM, Wilches-Luna EC, Hernandez-Sarmiento JM, et al. Preliminary results of a comparative yield study of induced sputum, string test, and gastric aspirate for the microbiological diagnosis of pulmonary tuberculosis in children. Am J Respir Crit Care Med 2010;181:A1775-A1775
39. Wright CA, Warren RW, Marais BJ. Fine needle aspiration biopsy: an undervalued diagnostic modality in pediatric mycobacterial disease. Int J Tuberc Lung Dis 2009;13:1467-1475
40. Rachow A, Clowes P, Saathoff E, et al. Increased and expedited case detection by Xpert MTB/RIF assay in childhood tuberculosis: a prospective cohort study. Clin Infect Dis 2012;54:1388-1396
41. Nicol MP, Workman L, Isaacs W, et al. Accuracy of the Xpert MTB/RIF test for the diagnosis of pulmonary tuberculosis in children admitted to hospital in Cape Town, South Africa: a descriptive study. Lancet Infect Dis 2011;11:819-824
42. Desk-guide for the diagnosis and management of TB in children. Paris: International Union Against Tuberculosis and Lung Disease, 2010 (http://www.theunion.org/index.php/en/resources/scientific-publications/tuberculosis/item/193-desk-guide-for-diagnosis-and-management-of-tb-in-children-).
43. WHO rapid advice — treatment of tuberculosis in children. Geneva: World Health Organization, 2010 (WHO/HTM/TB/2010.13).
44. Volmink J, Garner P. Directly observed therapy for treating tuberculosis. Cochrane Database Syst Rev 2007;4:CD003343-CD003343
45. Schaaf HS, Marais BJ. Management of multidrug-resistant tuberculosis in children: a survival guide for paediatricians. Paediatr Respir Rev 2011;12:31-38
46. Ettehad D, Schaaf HS, Seddon JA, Cooke G, Ford N. Treatment outcomes for children with multidrug-resistant tuberculosis: a systematic review and meta-analysis. Lancet 2012 February 24 (Epub ahead of print).
47. Blanc FX, Sok T, Laureillard D, et al. Earlier versus later start of antiretroviral therapy in HIV-infected adults with tuberculosis. N Engl J Med 2011;365:1471-1481
Free Full Text | Web of Science | Medline
48. Torok ME, Yen NT, Chau TT, et al. Timing of initiation of antiretroviral therapy in human immunodeficiency virus (HIV)-associated tuberculous meningitis. Clin Infect Dis 2011;52:1374-1383
49. Guidance for national tuberculosis and HIV programmes on the management of tuberculosis in HIV-infected children: recommendations for a public health approach, 2010. Paris: International Union Against Tuberculosis and Lung Disease, 2010.
50. Guidelines for the prevention and treatment of opportunistic infections among HIV-exposed and HIV-infected children. MMWR Morb Mortal Wkly Rep 2009;58:1-166http://www.cdc.gov/mmwr/preview/mmwrhtml/rr58e0826a1.htm
51. Munoz FM, Ong LT, Seavy D, Medina D, Correa A, Starke JR. Tuberculosis among adult visitors of children with suspected tuberculosis and employees at a children's hospital. Infect Control Hosp Epidemiol 2002;23:568-572
52.Trunz BB, Fine P, Dye C. Effect of BCG vaccination on childhood tuberculous meningitis and miliary tuberculosis worldwide: a meta-analysis and assessment of cost-effectiveness. Lancet 2006;367:1173-1180
53. Revised BCG vaccination guideline for infants at risk of HIV infection. Wkly Epidemiol Rec 2007;82:193-196
54. Marais BJ, Ayles H, Graham SM, Godfrey-Faussett P. Screening and preventive therapy for tuberculosis. Clin Chest Med 2009;30:827-846
55. Gomes VF, Andersen A, Wejse C, et al. Impact of tuberculosis exposure at home on mortality in children under 5 years of age in Guinea-Bissau. Thorax 2011;66:163-167
56. Hill PC, Rutherford ME, Audas R, van Crevel R, Graham SM. Closing the policy-practice gap in the management of child contacts of tuberculosis in developing countries. PLoS Med 2011;8:e1001105-e1001105
57. Spyridis NP, Spyridis PG, Gelesme A, et al. The effectiveness of a 9-month regimen of isoniazid alone versus 3- and 4-month regimens of isoniazid plus rifampin for treatment of latent tuberculosis infection in children: results of an 11-year randomized study. Clin Infect Dis 2007;45:715-722
58. Sterling TR, Villarino ME, Barosimov AS, et al. Three months of rifapentine and isoniazid for latent tuberculosis infection. N Engl J Med 2011;365:2155-2166
59. Zar HJ, Cotton MF, Strauss S, et al. Effect of isoniazid prophylaxis on mortality and incidence of tuberculosis in children with HIV: randomised controlled trial. BMJ 2007;334:136-136
60. Madhi SA, Nachman S, Violari A, et al. Primary isoniazid prophylaxis against tuberculosis in HIV-exposed children. N Engl J Med 2011;365:21-31


No hay comentarios:
Publicar un comentario