Enfermedad renal crónica (Guía de practica clínica)
Recomendaciones actualizadas: Guía 2012 para la evaluación, manejo y tratamiento de la enfermedad renal crónica que no se encuentre bajo terapia de reemplazo renal.
Dres. Paul E. Stevens, Adeera Levin
Ann Intern Med. 2013;158:825-830.
En 2012, la organización Kidney Desease: Improving Global Outcome (KDIGO) desarrolló una guía para la práctica clínica sobre la evaluación, el manejo y el tratamiento de la enfermedad renal crónica (ERC) en adultos y niños que no estén bajo tratamiento de reemplazo renal.
Recomendaciones relacionadas con la definición y la clasificación de la enfermedad renal crónica
1.1.1. La ERC comprende las anormalidades de la estructura o la función renal que persisten durante más de 3 meses, con afectación de la salud (no clasificada)
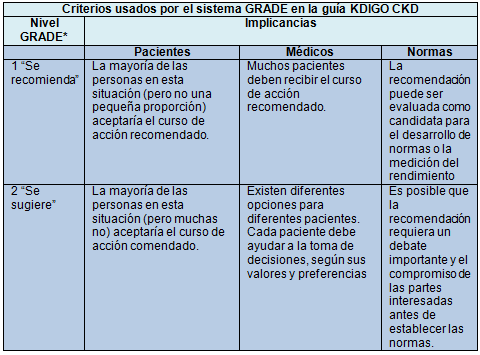
*GRADE: Grading of Recommendations Assessment, Development and Evaluation (GRADE corto). Grupo de trabajo que en 2000 comenzó a realizar una colaboración informal para abordar las deficiencias de los sistemas de clasificación actuales para el cuidado de la salud. Sistema que califica la calidad de la evidencia y el poder de las recomendaciones
Criterios para la enfermedad renal crónica*
Marcadores de daño renal ≥ (≥1 mes a >3 meses)
|
RAC: relación albúmina-creatinina; IFG: índice de filtrado glomerular
Como umbral diagnóstico se mantuvieron el índice de filtrado glomerular (IFG) <60 ml/min/1,73 m2 y la relación albúmina-creatinina (RAC) ≥30 mg/g. Esto fue impulsado por los estudios que examinaron el riesgo de mortalidad general y cardiovascular, la lesión renal aguda, la progresión de la ERC y la insuficiencia renal en la población general y en las poblaciones con mayor riesgo de enfermedad cardiovascular. Sin embargo, el agregado de "afectación de la salud» refleja la noción de que aunque en el riñón existen diversas anormalidades estructurales o funcionales, no todas afectan la salud.
Por ejemplo, si bien la disminución del IFG relacionada con la edad se observa tanto en los estudios longitudinales como en los de sección transversal, tiene una variación considerable. Un IFG <60 ml/min/1,73 m2 representa menos de la mitad del valor normal en los hombres y mujeres adultos jóvenes (en quienes el valor aproximado es de 125 ml/min/1,73 m2) y se asocia con un riesgo mayor de complicaciones de la ERC que en las personas con enfermedad renal crónica e IFG conservado.
No se conocen por completo los mecanismos que subyacen a estas asociaciones, pero se reconoce un efecto clínicamente importante como la reducción del IFG por toxicidad farmacológica, complicaciones endocrinas y metabólicas, riesgo de la enfermedad cardiovascular y muerte. Esto es relevante para todos los pacientes con una reducción del IFG, sin importar el lugar geográfico, la edad, o la causa. Un cociente RAC de 30 mg/g es 3 veces más elevado que el valor normal en hombres y mujeres jóvenes (valor aproximado, 10 mg/g) y se asocia con un riesgo mayor de complicaciones de la ERC.
1.2.1. Se recomienda clasificar la ERC en base en la causa, el IFG y la albuminuria. (1B)
La nueva clasificación abarca la causa y la gravedad de la enfermedad. Es fundamental identificar la causa de la ERC para predecir la evolución y orientar la elección del tratamiento etiológico. La gravedad está expresada por el nivel de IFG y la albuminuria y está relacionada con el riesgo de resultados adversos, incluyendo la muerte y la afectación del riñón.
Se mantuvo la clasificación de las 5 etapas de la ERC basada en el nivel del IFG, pero con una subdivisión de la categoría G3 (30 a 59 ml/min/1,73 m2) en categoría G3a (45 a 59 ml/min/1.73 m2) y categoría G3b (30 a 44 ml/1,73 m2). Otras complicaciones se asocian con niveles más bajos de IFG, como la infección, el deterioro de la función cognitiva y física, y las amenazas para la seguridad de los pacientes.
Para simplificar la evaluación y el pronóstico se propusieron 3 categorías de albuminuria. Puede ser apropiado hacer una clasificación adicional de los rangos más elevados y nefróticos (RAC >2.220 mg/g), los que se manejan en circunstancias específicas en centros especializados.
Recomendaciones para la evaluación del ifg y la albuminuria
Para calcular el IFG estimado (IFGe) en adultos se ha recomendado la ecuación de la Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI), que mide la creatininemia mediante un análisis calibrado por el método de referencia de la espectrometría de masas por dilución de isótopos. Una revisión sistemática avaló esta recomendación (nivel de evidencia 1B).
La ecuación del CKD-EPI tiene menos problemas que la ecuación del estudio MDRD (Modificación de la Dieta en Enfermedad Renal), especialmente cuando el IFG es ≥60 ml/min/1,73 m2; ofrece una pequeña mejora en la precisión y mayor certeza. La selección de una sola ecuación debería facilitar la comunicación entre los prestadores, pacientes, investigadores, y funcionarios de Salud Pública. Sin embargo, cuando se cuenta con la ecuación CKD-EPI modificada es preferible a las ecuaciones no modificadas porque puede usarse en otros grupos raciales y étnicos y con ecuaciones validadas adaptadas a un país o región específicos.
1.4.3.5. Si es necesario confirmar la ER, en adultos con un IFGe basado en la creatinina (IFGe-creat) de 45-59 ml/min/1,73 m2 y sin otros marcadores de daño renal, los autores sugieren medir la cistatina C. (2C)
La guía reconoce que el análisis de la cistatina C. es un tema controvertido con posibles consecuencias económicas sanitarias, y que no todos los laboratorios están en condiciones de hacerlo. En las personas sin albuminuria (categoría A1) u otros marcadores de daño renal, la evidencia avala el uso del IFGe-basado en la cistatina (IFGe-cist), en especial en los pacientes con un IFGe de 45 a 59 ml/min/1,73 m2 (categoría G3a).
Este grupo representa el 3,6% de la población de EE. UU. y el 41% de las personas de ese país que se estima tienen ERC diagnosticada mediante el IFGe-creat y la albuminuría solos. Debido a que en estas personas el diagnóstico de ERC es un tema muy controvertido, con potenciales consecuencias para el rotulado de la enfermedad, sería de gran utilidad contar con un marcador que permita confirmar su presencia.
A tal efecto el uso del IFGe-cist en la población ha mostrado que dos tercios de las personas con un IFGe-creat <60 ml/min/1,73 m2 tiene el diagnóstico de ERC confirmado por presentar un IFGe-cist <60 ml/min/1,73 m2 con un riesgo muy elevado de muerte, enfermedad cardiovascular y enfermedad renal terminal, comparado con aquellos con IFGe-cist >60 ml/min/1,73 m2.
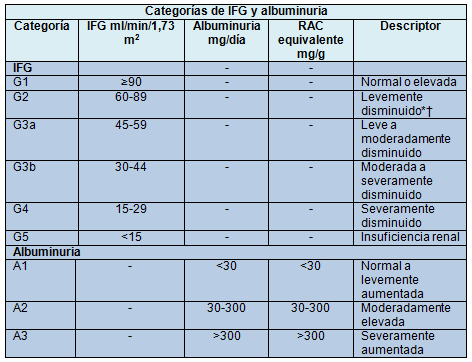
1.4.4.2. Se recomienda que además de la albuminemia o la proteinuria, los laboratorios clínicos informen la RAC y la relación proteína:creatinina (RPC) en muestras de orina recogidas al azar y no solo las concentraciones. (1B)
Por muchas razones, para evaluar la proteinuria se recomienda medir la RAC urinaria en vez de la proteinuria total. En la mayoría de los casos de ERC, la proteína más importante que se pierde por la orina es la albúmina. En los estudios de población, la RAC urinaria predice con precisión los riesgos renales y cardiovasculares.
En los trabajos de intervención para disminuir la presión arterial o bloquear el sistema renina-angiotensina-aldosterona (SRAA), la reducción de la RAC mejoró la progresión de la ERC. La RAC urinaria tiene mayor sensibilidad para detectar la albuminuria de bajo grado pero clínicamente importante y es más precisa en presencia de concentraciones bajas pero clínicamente importantes.
1.4.4.2.1. los laboratorios ya no deben utilizar el término microalbuminuria (no clasificado)
Aunque durante décadas la significancia de la categoría A2 de la RAC (30 a 300 mg/g) comprendía a las personas con diabetes, el uso de esta categoría para indicar la ERC, especialmente en aquellos con IFG más elevado, sigue siendo controvertido. Sin embargo, los datos demuestran que con cualquier nivel de IFG existe el riesgo de mala evolución y que este aumento del riesgo es continuo. Por lo tanto se ha sugerido que ya no se utilice más el término “microalbuminuria”.
Recomendaciones para el monitoreo de la enfermedad renal crónica
Las personas con ERC deben ser evaluados al menos 1 vez por año. La frecuencia exacta del monitoreo del IFG y de la RAC dependerá de la gravedad de la ERC y del riesgo y velocidad de la progresión. Los factores asociados con la progresión son: la causa de la ERC, el nivel del IFG, el nivel de la albuminuria, la lesión renal aguda, la edad, el sexo, la raza o la etnia, la hipertensión arterial, la hiperglucemia, la dislipidemia, el tabaquismo, la obesidad, el antecedente de enfermedad cardiovascular, la exposición a agentes nefrotóxicos y otros.
Las fluctuaciones pequeñas del IFG son comunes y no necesariamente indican progresión. Para definir la progresión se ha recomendado la evaluación de los cambios del IFGe confirmados por un porcentaje mínimo de cambio del IFGe (≥25%). La razón de esto fue que aunque los estudios de cohorte longitudinales que examinan la progresión han asumido que la progresión es lineal, no siempre es así.
Cuanto mayor es la fluctuación de la función renal, mayor es la probabilidad de una progresión no lineal. Un criterio que requiere un cambio en la categoría del IFG (es decir, de categoría G2 a G3a) y el porcentaje del cambio aseguraría que los pequeños cambios en el IFG (por ejemplo, de 61 a 59 ml/min/1,73 m2, que representa un cambio en la categoría pero un cambio mínimo en el IFG) podría no ser malinterpretado para representar la progresión. Estudios preliminares han mostrado que este abordaje identifica a aquellos con riego aumentado.
Los datos fueron insuficientes para fundamentar las recomendaciones que definen la progresión de la albuminuria, aunque los niveles más elevados de albuminuria indican la progresión y se ha comprobado que se asocian con mayor riesgo de mala evolución.
Manejo de la enfermedad renal crónica
En la guía se detallan muchas recomendaciones para prevenir la progresión de la ERC y el manejo de sus complicaciones específicas. Las recomendaciones fundamentales para el control de la presión arterial, la reducción de la proteinuria, la lesión renal aguda y la enfermedad cardiovascular están resumidas.
3.1.4 Los adultos diabéticos y no diabéticos con ERC y una albuminuria <30 mg/24 horas (o equivalente) cuya presión arterial sistólica en el consultorio sea constantemente >140 mm Hg o diastólica >90 mm Hg, deben ser tratados con antihipertensivos, para mantener una presión arterial sistólica constante ≤140 mm Hg y diastólica ≤90 mm Hg. (1B)
3.1.5 Se sugiere que los adultos diabéticos y no diabéticos con ERC y albuminuria ≥30 mg/24 horas (o equivalente), cuya presión arterial sistólica constante en el consultorio es >130 mm Hg o diastólica >80 mm Hg sean tratados con antihipertensivos para mantener la presión arterial constante ≤130 mm Hg y diastólica ≤80 mm Hg. (2D)
3.1.7 Para los adultos diabéticos y no diabéticos con ERC y albuminuria >300 mg/24 horas (o equivalente), se recomienda utilizar un bloqueante de los receptores de angiotensina o un inhibidor de la enzima convertidora de angiotensina. (1B)
El control de la presión arterial y la reducción de la proteinuria son muy importantes para prevenir la progresión de la ERC. Los estudios han mostrado en forma repetida que la reducción de la proteinuria mediante el bloqueo del SRAA hace más lenta la progresión, tanto de la nefropatía diabética como la enfermedad renal no diabética.
El descenso de la presión arterial también hace más lenta la progresión de la ERC, rompiendo potencialmente el círculo vicioso que hay entre la hipertensión y la ERC. En cuanto a la prevención de la progresión de la ERC, la evidencia es insuficiente para recomendar el uso de los 2 tipos de antihipertensivos mencionados. Al formular declaraciones acerca del control de la presión arterial y el bloqueo del SRAA, se siguieron las recomendaciones de la guía KJDIGO sobre el control de la presión arterial.
Las intervenciones en el estilo de vida (dieta hiposódica con <2 g/día de sal, alcanzar un índice de masa corporal de 20 a 25 kg/m2, cesar de fumar y 30 minutos de ejercicio diarios, 5 veces por semana) y el buen control de la diabetes (hemoglobina glicosilada objetivo, 7%) también están relacionados con la reducción de la proteinuria y la atenuación de la progresión de la ERC.
3.1.12. Se recomienda que todas las personas con ERC sean consideradas en mayor riesgo de lesión renal aguda. (1A)
El objetivo de esta recomendación fue destacar la compleja relación que hay entre la ERC y la lesión renal aguda. La evidencia demuestra que la ERC es independiente del factor de riesgo de lesión renal aguda, aun después de hacer ajustes usando como variables otras enfermedades.
Existe abundante evidencia que indica que la lesión renal aguda es un factor de riesgo de ERC y su progresión. Tanto la prevalencia de la ERC como la de lesión renal aguda aumentan con la edad (los autores destacan que somos una población que envejece).
4.1.2 Se recomienda que el nivel asistencial para la cardiopatía isquémica en las personas con ERC no debe estar influenciado negativamente por la ERC. (1A)
Las personas con ERC tienen más posibilidad de tener un evento cardiovascular que progresar a una nefropatía terminal; después de un infarto agudo de miocardio tienen peor pronóstico con mayores tasas de mortalidad y mayor riesgo de infarto de miocardio recurrente, insuficiencia cardíaca y muerte súbita de origen cardíaco. A pesar de esto, el nivel asistencial ofrecido a las personas con ERC sigue siendo frecuentemente subóptimo.
Comentarios
Actualmente, el sistema de clasificación de la ERC comprende la causa de la ERC, la categoría del IFG y la categoría de la albuminuria. Este enfoque tridimensional se basa en la versión anterior más sencilla; el momento de los cambios es apropiado, dada la actual familiaridad que tienen los médicos generales con la versión más simple, y la necesidad de abordar los malentendidos comunes de una manera sistemática.
Se ha argumentado que factores adicionales como la presión arterial deben ser incluidos en la clasificación; sin embargo, al mismo tiempo que se redefinió el sistema de estadificación existente, los autores también quisieron mantener la simplicidad y la aplicabilidad más fácil de un sistema de clasificación para la práctica clínica, la investigación y la salud pública.
Por lo tanto, eligieron incluir solamente las mediciones relacionadas con el riñón, considerando también la causa de la ERC y los conocimientos de las verdaderas diferencias en la historia natural de la enfermedad renal de diferente etiología. La clasificación revisada brinda un marco para los informes e investigaciones de la ERC de la próxima década.
Todavía queda por establecer si en las personas mayores la disminución del IFG o el aumento de la RAC representan una enfermedad o solamente el “envejecimiento normal”, por loqueo el rotulado de la enfermedad continuará provocando controversias en una sociedad que envejece.
Las personas >75 años tienen un espectro de IFG >60 ml/min/1,73 m2, con y sin albuminuria, pero también tienen IFG <60 ml/min/1,73 m2 . El envejecimiento se asocia con la acumulación de condiciones comórbidas y el uso de medicamentos que pueden reducir el IFG y provocar albuminuria, siendo éste un aspecto poco apreciado por el argumento acerca del envejecimiento y el IFGe.
No es accidental que el 37% de las recomendaciones de la guía no fueron clasificadas y solo el 10% fue calificada “A” por la calidad de la evidencia. Muchas de las investigaciones realizadas en la década pasada han tenido como objetivo la definición y la evaluación de la ERC, junto con la identificación de las personas con ERC y la descripción de los resultados adversos asociados.
Los autores mencionan algunos buenos ensayos sobre intervenciones como el bloqueo del SRAA y el tratamiento de la ERC con estatinas, y también hacen referencia a algunos datos en otras áreas, como el tratamiento con bicarbonato de la acidosis y manifiestan que si se quiere modificar los resultados se necesitan muchos más datos.
Es necesario conocer exactamente cuáles son las intervenciones útiles para prevenir o atenuar la progresión de la ERC y los resultados adversos asociados, y cuándo esas intervenciones deben ser aplicadas. También es necesario conocer cuándo se puede considerar que las intervenciones beneficiosas pueden realmente entrañar algún peligro. Por ejemplo, el uso indiscriminado de los bloqueantes del SRAA en las personas con IFG disminuido, solo para tratar específicamente la hipertensión las expone a un riesgo adicional de lesión renal aguda, sin beneficio. En relación a estas áreas, es necesario conocer mucho mejor las definiciones de la progresión de la ERC y cómo afectan la práctica clínica y los ensayos de investigación, como la asociación de la lesión renal aguda con la ERC se relaciona con la progresión y si se puede influir positivamente en esta relación.
Referencias
1. National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis. 2002;39:S1-266. [PMID: 11904577]
2. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int Suppl. 2013;3:1-150.
3. Atkins D, Best D, Briss PA, Eccles M, Falck-Ytter Y, Flottorp S, et al; GRADE Working Group. Grading quality of evidence and strength of recommendations. BMJ. 2004;328:1490. [PMID: 15205295]
4. Guyatt GH, Oxman AD, Kunz R, Falck-Ytter Y, Vist GE, Liberati A, et al; GRADE Working Group. Going from evidence to recommendations. BMJ. 2008;336:1049-51. [PMID: 18467413]
5. Uhlig K, Macleod A, Craig J, Lau J, Levey AS, Levin A, et al. Grading evidence and recommendations for clinical practice guidelines in nephrology. A position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int. 2006;70:2058-65. [PMID: 17003817]
6. Astor BC, Matsushita K, Gansevoort RT, van der Velde M, Woodward M, Levey AS, et al; Chronic Kidney Disease Prognosis Consortium. Lower estimated glomerular filtration rate and higher albuminuria are associated with mortality and end-stage renal disease. A collaborative meta-analysis of kidney disease population cohorts. Kidney Int. 2011;79:1331-40. [PMID: 21289598]
7. Gansevoort RT, Matsushita K, van der Velde M, Astor BC, Woodward M, Levey AS, et al; Chronic Kidney Disease Prognosis Consortium. Lower estimated GFR and higher albuminuria are associated with adverse kidney outcomes. A collaborative meta-analysis of general and high-risk population cohorts. Kidney Int. 2011;80:93-104. [PMID: 21289597]
8. Matsushita K, van der Velde M, Astor BC, Woodward M, Levey AS, de Jong PE, et al; Chronic Kidney Disease Prognosis Consortium. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet. 2010;375:2073-81. [PMID: 20483451]
9. van der Velde M, Matsushita K, Coresh J, Astor BC, Woodward M, Levey A, et al; Chronic Kidney Disease Prognosis Consortium. Lower estimated glomerular filtration rate and higher albuminuria are associated with all-cause and cardiovascular mortality. A collaborative meta-analysis of high-risk population cohorts. Kidney Int. 2011;79:1341-52. [PMID: 21307840]
10. Levey AS, de Jong PE, Coresh J, El Nahas M, Astor BC, Matsushita K, et al. The definition, classification, and prognosis of chronic kidney disease: a KDIGO Controversies Conference report. Kidney Int. 2011;80:17-28. [PMID: 21150873]
11. Earley A, Miskulin D, Lamb EJ, Levey AS, Uhlig K. Estimating equations for glomerular filtration rate in the era of creatinine standardization: a systematic review. Ann Intern Med. 2012;156:785-95. [PMID: 22312131]
12. Peralta CA, Shlipak MG, Judd S, Cushman M, McClellan W, Zakai NA, et al. Detection of chronic kidney disease with creatinine, cystatin C, and urine albumin-to-creatinine ratio and association with progression to end-stage renal disease and mortality. JAMA. 2011;305:1545-52. [PMID: 21482744]
13. Waheed S, Matsushita K, Sang Y, Hoogeveen R, Ballantyne C, Coresh J, et al. Combined association of albuminuria and cystatin C-based estimated GFR with mortality, coronary heart disease, and heart failure outcomes: the Atherosclerosis Risk in Communities (ARIC) Study. Am J Kidney Dis. 2012;60:207-16. [PMID: 22537422]
14. Rifkin DE, Katz R, Chonchol M, Fried LF, Cao J, de Boer IH, et al. Albuminuria, impaired kidney function and cardiovascular outcomes or mortality in the elderly. Nephrol Dial Transplant. 2010;25:1560-7. [PMID: 20008829]
15. Gross JL, de Azevedo MJ, Silveiro SP, Canani LH, Caramori ML, Zelmanovitz T. Diabetic nephropathy: diagnosis, prevention, and treatment. Diabetes Care. 2005;28:164-76. [PMID: 15616252]
16. Ninomiya T, Perkovic V, de Galan BE, Zoungas S, Pillai A, Jardine M, et al; ADVANCE Collaborative Group. Albuminuria and kidney function independently predict cardiovascular and renal outcomes in diabetes. J Am Soc Nephrol. 2009;20:1813-21. [PMID: 19443635]
17. Viazzi F, Leoncini G, Conti N, Tomolillo C, Giachero G, Vercelli M, et al. Combined effect of albuminuria and estimated glomerular filtration rate on cardiovascular events and all-cause mortality in uncomplicated hypertensive patients. J Hypertens. 2010;28:848-55. [PMID: 20087212]
18. Shastri S, Katz R, Shlipak MG, Kestenbaum B, Peralta CA, Kramer H, et al. Cystatin C and albuminuria as risk factors for development of CKD stage 3:the Multi-Ethnic Study of Atherosclerosis (MESA). Am J Kidney Dis. 2011;57: 832-40. [PMID: 21296473]
19. Hallan SI, Ritz E, Lydersen S, Romundstad S, Kvenild K, Orth SR. Combining GFR and albuminuria to classify CKD improves prediction of ESRD. J Am Soc Nephrol. 2009;20:1069-77. [PMID: 19357254]
20. Lamb EJ, MacKenzie F, Stevens PE. How should proteinuria be detected and measured? Ann Clin Biochem. 2009;46:205-17. [PMID: 19389884]
21. Li L, Astor BC, Lewis J, Hu B, Appel LJ, Lipkowitz MS, et al. Longitudinal progression trajectory of GFR among patients with CKD. Am J Kidney Dis. 2012;59:504-12. [PMID: 22284441]
22. O’Hare AM, Batten A, Burrows NR, Pavkov ME, Taylor L, Gupta I, et al. Trajectories of kidney function decline in the 2 years before initiation of longterm dialysis. Am J Kidney Dis. 2012;59:513-22. [PMID: 22305760]
23. Turin TC, Coresh J, Tonelli M, Stevens PE, de Jong PE, Farmer CK, et al. One-year change in kidney function is associated with an increased mortality risk. Am J Nephrol. 2012;36:41-9. [PMID: 22699706]
24. Turin TC, Coresh J, Tonelli M, Stevens PE, de Jong PE, Farmer CK, et al. Short-term change in kidney function and risk of end-stage renal disease. Nephrol Dial Transplant. 2012;27:3835-43. [PMID: 22764191]
25. Turin TC, Coresh J, Tonelli M, Stevens PE, de Jong PE, Farmer CK, et al. Change in the estimated glomerular filtration rate over time and risk of all-cause mortality. Kidney Int. 2013. [PMID: 23344477]
26. Kidney Disease: Improving Global Outcomes (KDIGO) BP Work Group. KDIGO clinical practice guideline for the management of blood pressure in chronic kidney disease. Kidney Int Suppl. 2012;2:337-414.
27. Jones-Burton C, Mishra SI, Fink JC, Brown J, Gossa W, Bakris GL, et al. An in-depth review of the evidence linking dietary salt intake and progression of chronic kidney disease. Am J Nephrol. 2006;26:268-75. [PMID: 16763384]
28. Navaneethan SD, Yehnert H, Moustarah F, Schreiber MJ, Schauer PR, Beddhu S. Weight loss interventions in chronic kidney disease: a systematic review and meta-analysis. Clin J Am Soc Nephrol. 2009;4:1565-74. [PMID: 19808241]
29. Wakasugi M, Kazama JJ, Yamamoto S, Kawamura K, Narita I. A combination of healthy lifestyle factors is associated with a decreased incidence of chronic kidney disease: a population-based cohort study. Hypertens Res. 2012. [PMID: 23171953]
30. National Kidney Foundation. KDOQI Clinical Practice Guideline for Diabetes and CKD: 2012 Update. Am J Kidney Dis. 2012;60:850-86. [PMID: 23067652]
31. Bedford M, Farmer C, Levin A, Ali T, Stevens P. Acute kidney injury and CKD: chicken or egg? [Editorial]. Am J Kidney Dis. 2012;59:485-91. [PMID: 22444492]
32. Herzog CA, Asinger RW, Berger AK, Charytan DM, Dı´ez J, Hart RG, et al. Cardiovascular disease in chronic kidney disease. A clinical update from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int. 2011;80: 572-86. [PMID: 21750584]
33. Burgos-Calderon R, Depine S. Systematic approach for the management of chronic kidney disease: moving beyond chronic kidney disease classification. Curr Opin Nephrol Hypertens. 2010;19:208-13. [PMID: 19779338]
34. Remuzzi G, Benigni A, Remuzzi A. Mechanisms of progression and regression of renal lesions of chronic nephropathies and diabetes. J Clin Invest. 2006;116:288-96. [PMID: 16453013]
35. Baigent C, Landray MJ, Reith C, Emberson J, Wheeler DC, Tomson C, et al; SHARP Investigators. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet. 2011;377:2181-92. [PMID: 21663949]


No hay comentarios:
Publicar un comentario