Terapéutica: El tratamiento de las várices gástricas fúndicas sangrantes con cianoacrilato constituye una excelente opción, habiendo demostrado muy buenos resultados de hemostasia y seguridad.
Dres. Iván Mosca, Regina Ligorría, Francisco Tufare, Augusto Villaverde, Fernando Baldoni, Horacio Martínez, Néstor ChopitaActa Gastroenterol Latinoam 2012;42:27-32
Introducción
Las várices gástricas están presentes en cerca del 20% de los pacientes con hipertensión portal. El riesgo de sangrado de las mismas es de 50% a 80%, con una mortalidad cercana al 45%.1 Si bien sangran menos frecuentemente que las esofágicas, cuando lo hacen su severidad es mayor y el control más dificultoso. De los métodos disponibles para su tratamiento, las terapias de obturación constituyen la opción de primera línea para las várices del fundus gástrico que, según Sarin y col se clasifican en GOV (gastric oesophageal varices) 1 (curvatura menor), GOV 2 (curvatura mayor) e IGV (isolated gastric varices).2 Dicho procedimiento fue descripto por primera vez por Nib Soehendra en 1986 en Alemania y a partir de entonces se difundió en varios países del mundo.
Respecto a su eficacia, ha demostrado excelentes tasas de hemostasia primaria y disminuyó ostensiblemente las tasas de resangrado en comparación con otros procedimientos utilizados, como la ligadura con bandas elásticas y la escleroterapia (polidocanol, alcohol absoluto, solución hipertónica).3 Pero no está exento de complicaciones, algunas de las cuales pueden ser letales, como la embolia sistémica del producto inyectado y la sepsis. Afortunadamente, éstas son muy poco frecuentes, sobre todo si se lleva a cabo una técnica correcta. Uno de los inconvenientes de las terapias de obturación es la disponibilidad de personal experimentado y el temor al daño del instrumental durante el procedimiento.
En nuestro país, existen pocos centros donde se lleva a cabo este procedimiento, siendo la mayoría de los pacientes intervenidos quirúrgicamente o derivados a centros de endoscopía especializados.
Materiales y métodos
Pacientes: En este estudio observacional, descriptivo y retrospectivo se analizaron 65 pacientes de ambos sexos, mayores de 14 años, que consultaron espontáneamente, fueron derivados de otra institución o se encontraban internados en el Hospital Interzonal General de Agudos San Martín desde enero de 1999 a diciembre de 2008.
Los criterios de inclusión fueron: 1) pacientes con várices GOV 1, GOV 2 o IGV 1, con sangrado activo o estigmas de reciente sangrado; y 2) pacientes con várices gástricas con antecedentes de sangrado por las mismas. Las várices fúndicas (VF) debieron ser vírgenes de tratamiento con cianoacrilato.
Los criterios de exclusión fueron: 1) edad menor de 15 años; 2) embarazo; 3) realización de una derivación portosistémica transyugular intrahepática (TIPS) o una cirugía derivativa previa; y 4) falla multiorgánica.
Métodos
Se utilizaron endoscopios Olympus ® (series 145 y 160) y agujas de esclerosis de 23 gauge. El material a inyectar consistió en una mezcla de lipiodol y Nbutil- 2-cianoacrilato (Histoacryl ®), en relación 1:1.
En cada procedimiento se dispuso de un enfermero asistente de endoscopía, un médico endoscopista de planta y un médico residente de gastroenterología. En todos los casos de sangrado agudo se realizó tratamiento farmacológico con octreótido endovenoso (hasta 3 bolos durante la endoscopía, luego en infusión continua a 50 mcg/hora por 72 horas y luego 100 mcg cada 8 horas por vía subcutánea durante 48 horas). En los pacientes con ascitis serealizó tratamiento antibiótico con 1 g de cefotaxima por vía endovenosa antes del procedimiento y 400 mg de norfloxacina oral cada 12 horas durante 7 días desde la admisión. Entre el cuarto y el séptimo día posterior a la inyección de cianoacrilato se realizó una endoscopía de control para verificar la induración de la várice, tocándola suavemente con el extremo de un catéter. En caso de constatarse áreas no induradas, se aplicó nuevamente cianoacrilato. Previamente al alta los pacientes fueron evaluados por un cardiólogo para iniciar un tratamiento con betabloqueantes. Durante la internación se estadificó la función hepática mediante el score de Child-Pugh y se determinó la etiología de la hipertensión portal (HP).
Técnica La técnica empleada fue la estandarizada por Soehendra y col en 1986:4
1. Preparar todo el material a usar: jeringas de 2 ml de lavado con agua destilada, jeringa de 2 ml con 0,8 ml de lipiodol y 0,5 ml de cianoacrilato, aceite de silicona, aguja de esclerosis de 0,8 mm de diámetro y 8 mm de longitud, gafas de protección ocular.
2. Aplicar aceite de silicona en el interior del canal de trabajo y en el extremo del endoscopio.
3. Para prevenir la adherencia del cianoacrilato con el inyector, poner escasa cantidad de lipiodol en el mismo e inyectar aire con el fin de que aquel se adhiera a las paredes internas del inyector.
4. Inyectar la mezcla de lipiodol y cianoacrilato dentro de la várice a tratar. Seguidamente inyectar 0,8 ml de agua destilada para liberar la mezcla del adhesivo dentro de la várice. Es aconsejable medir el volumen de espacio muerto del catéter inyector que generalmente es de 0,8 ml.
5. Retirar la aguja de la várice y lavar enérgicamente con agua destilada.
6. Constatar la induración tocando suavemente la várice con el extremo del catéter.
7. Durante el procedimiento mantener el estómago insuflado y no aspirar.
8. Colocar gafas de protección ocular al personal de trabajo y al paciente.
Definiciones • Hemostasia: estabilidad de los signos vitales y ausencia de resangrado evidenciable (hematemesis franca, sangre fresca por sonda nasogástrica, caída de la hemoglobina mayor o igual a 2 g/dl).
• Hemostasia primara: la obtenida luego de la primera sesión de tratamiento.
• Hemostasia definitiva: la última obtenida, sin posterior resangrado, indistintamente del número de sesiones.
• Resangrado: sangrado activo desde una várice tratada, visto durante la endoscopía o manifestado como hematemesis y/o melena asociadas a una disminución de la hemoglobina mayor o igual a 2 g/dl.
• Tasa de resangrado global: la sumatoria de episodios de resangrado, indistintamente del momento en que ocurra.
• Sesión: tiempo endoscópico en el que se llevó a cabo el tratamiento de una várice con cianoacrilato.
• Erradicación de várices fúndicas: desaparición de la/s várice/s tratada/s con cianoacrilato.
Resultados
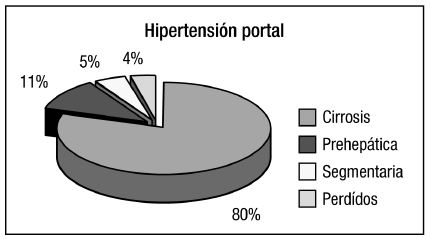
Se incluyeron 65 pacientes, 42 hombres y 23 mujeres, con una edad media de 53,8 años (rango 18 a 76 años), siendo el grupo etáreo predominante el de 46 a 75 años (87%). La causa de la HP fue cirrosis en 52 pacientes (80%), HP pre-hepática en 7 (10,8%), HP segmentaria en 3 (4,6%) y no determinada en 3 (4,6%) (Figura 1). La clase funcional hepática de los 52 pacientes cirróticos, medida por el score de Child- Pugh, fue A en 21 casos (40,4%), B en 25 (48,1%) y C en 6 (11,5%). N-butil-2-cianoacrilato en el tratamiento de las várices gástricas Iván Mosca y col
Figura 1. Causas de hipertensión portal.
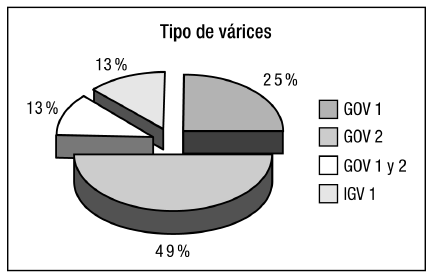
Al momento de la realización de la endoscopía, 56 pacientes (86%) se encontraban con hemorragiadigestiva y 9 (14%) fueron derivados para erradicación de sus várices. La media de cianoacrilato empleado fue de 0,88 ml (rango 0,5 a 3 ml). Se realizaron un promedio de 1,5 sesiones por paciente (rango 1 a 5 sesiones). El tipo de várices fúndicas presentes fue el que se muestra en la Figura 2, predominando las GOV 2.
Figura 2. Tipo de várices esofágicas
Se logró la hemostasia primaria en 50 (89%) de los 56 pacientes que se presentaron con hemorragia digestiva y 6 requirieron una segunda sesión (Figura 3). El hallazgo endoscópico en este grupo fue sangrado activo en 7 (12,5%), tapón plaquetario en 20 (35,6%), coágulo adherido en 9 (16%), úlcera sobre várice en 10 (17,8%) y várices tumorales en 10 (17,8%). Once pacientes (19,6%) presentaron resangrado dentro de las 6 semanas del tratamiento inicial. En 8 de ellos se logró hemostasia nuevamente con cianoacrilato, 2 requirieron tratamiento quirúrgico y 1 terapia endovascular. Por lo tanto, la tasa de hemostasia definitiva fue de 94,6%, existiendo solo 3 casos en los que se realizó otra terapéutica (Figura 4).
Figura 3. Hemostasia primaria.
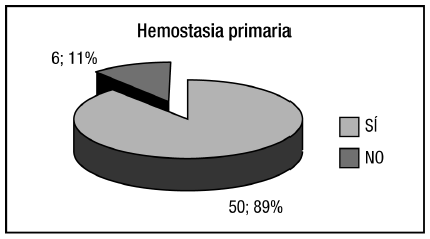
Figura 4. Hemostasia definitiva.
Se siguieron 53 pacientes por un período promedio de 11 meses (rango 1 a 81 meses). El mismo se llevó a cabo mediante la entrevista telefónica, la consulta ambulatoria o la demanda espontánea. Durante el seguimiento, 7 pacientes (12,5%) presentaron resangrado, obteniéndose hemostasia con cianoacrilato en todos los casos, y las várices se erradicaron en 21 (39,6%).
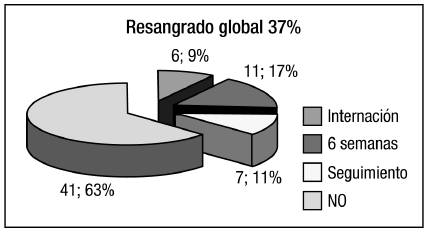
Considerando el total de la población, resangraron 24 pacientes (37%): luego de la primera sesión durante la internación 6, durante las 6 semanas posteriores al alta 11 y durante el seguimiento 7 (Figura 5). Con respecto a las complicaciones, se registró un caso de trombosis de la vena esplénica que respondió al tratamiento médico. No se registraron daños en el instrumental.
Figura 5. Resangrado global.
Discusión
La inyección endoscópica de N-butyl-2-cianoacrilato en las várices fúndicas sangrantes fue reportada por primera vez en 1986 por Soehendra y col.4 Este gel tisular se polimeriza en contacto con la sangre, solidificándose dentro de la várice instantáneamen
Discusión: La inyección endoscópica de N-butyl-2-cianoacrilato en las várices fúndicas sangrantes fue reportada por primera vez en 1986 por Soehendra y col.4 Este gel tisular se polimeriza en contacto con la sangre, solidificándose dentro de la várice instantáneamente, obliterándola y previniendo o deteniendo así el sangrado. El molde del gel cae espontáneamente entre semanas y meses después. Debido a su excelente eficacia, el cianoacrilato es considerado el tratamiento de primera línea para el sangrado por várices fúndicas en muchos países del mundo.
Dos estudios controlados mostraron que la inyección de cianoacrilato es superior a otros dos métodos de esclerosis propuestos: la inyección de alcohol5 y la de oleato de etanolamina.6 Otro estudio mostró la superioridad del cianoacrilato sobre la ligadura con bandas en el tratamiento de las várices fúndicas sangrantes.7 La hemostasia primaria fue mayor del 90% de los casos con cianoacrilato, en comparación con el 62% para el alcohol, el 57% para el oleato de etanolamina y el 40% para la ligadura con bandas elásticas. Existe un gran número de series de casos que demuestran que el tratamiento con cianoacrilato controla exitosamente el sangrado en más del 90% de los casos.7-14 A pesar de la amplia diseminación de este procedimiento en el tratamiento de las várices fúndicas sangrantes y los excelentes resultados obtenidos, existen diferencias en la literatura concernientes a la técnica, la seguridad y el resultado a largo plazo. En un estudio multicéntrico llevado a cabo en centros de Hamburgo (Alemania) y El Cairo (Egipto) se evaluaron los resultados obtenidos en el tratamiento de várices fúndicas sangrantes con cianoacrilato, siguiendo una técnica estandarizada. Se obtuvieron muy buenos resultados en cuanto a hemostasia, resangrado, erradicación, perfil de seguridad y daño del instrumental.15
En nuestro servicio hace más de 10 años que se realiza este procedimiento, siguiendo la técnica mencionada, con buenos resultados. Aunque no existe consenso, la indicación sigue siendo el tratamiento de las várices gástricas de techo con sangrado activo o previo (profilaxis secundaria). Con respecto a los resultados, tuvimos una tasa de hemostasia definitiva comparable con la propuesta en la literatura y un perfil de seguridad aceptable, aunque no tenemos registro de complicaciones menores (dolor, fiebre). La tasa de resangrado de 37% se acerca a los valores más altos publicados, probablemente debido a que la terapéutica se limitó solo a la várice sangrante y no a sus tributarias, como lo proponen otros autores.15
Dentro de las limitaciones de este trabajo está su naturaleza retrospectiva y la falta de un seguimiento estandarizado de los pacientes que motivó la pérdida en algunos y la falta de datos en otros. Existieron diferentes dificultades para el seguimiento de los pacientes, algunas relacionadas a la propia enfermedad, a las condiciones sociales y a la distancia de nuestro centro con los demás centros que derivan los pacientes. Esto hace que los datos sobre la erradicación de las várices no hayan sido obtenidos en todos los casos, lo que concuerda con lo publicado en la literatura mundial. Sin embargo, son pocos los centros en nuestro país que llevan a cabo este procedimiento y reportar su casuística permite el análisis del trabajo realizado para optimizar los resultados y contribuir al conocimiento general.
Se puede concluir que en nuestra experiencia el tratamiento de las várices gástricas fúndicas sangrantes con cianoacrilato constituye una excelente opción, habiendo demostrado muy buenos resultados de hemostasia y seguridad. Son necesarios estudios controlados prospectivos siguiendo un protocolo estandarizado que permitan evaluar con precisión la tasa de resangrado, erradicación y complicaciones
Temas recomendados
Bibliografía
1. Ryan BM, Stockbrugger RW, Ryan JM. A pathophysiologic,gastroenterologic, and radiologic approach to the management of gastric varices. Gastroenterology 2004;126:1175– 1189.
2. Sarin SK, Lahoti D, Saxena SP, Murthy NS, Makwana UK. Prevalence, classification and natural history of gastric varices: a long-term follow-up study in 568 portal hypertension patients. Hepatology 1992;16:1343-1349.
3. Park WG, Yeh RW, Triadafilopoulos G. Injection therapies for variceal bleeding disorders of the GI tract. Gastrointest Endosc 2008;67:313-323.
4. Soehendra N, Nam VC, Grimm H, Kempeneers I. Endoscopic obliteration of large esophagogastric varices with bucrylate. Endoscopy 1986;18:25–26.
5. Sarin SK, Jain AK, Jain M, Gupta R. A randomized controlled trial of cyano-acrylate versus alcohol injection in patients with isolated fundic varices. Am J Gastroenterol 2002;97:1010-1015.
6. Maluf-Filho F, Sakai P, Ishioka S, Matuguma SE. Endoscopic sclerosis versus cyanoacrylate endoscopic injection for the first episode of variceal bleeding: a prospective, controlled and randomized study in Child-Pugh class C patients. Endoscopy 2001;33:421-427.
7. Lo GH, Lai KH, Cheng JS, Chen MH, Chiang HT. A prospective, randomized trial of butylcyanoacrylate injection versus band ligation in the management of bleeding gastric varices. Hepatology 2001;33:1060-1064. N-butil-2-cianoacrilato en el tratamiento de las várices gástricas Iván Mosca y col 32t Acta Gastroenterológica Latinoamericana - Vol 42 / Nº 1 / Marzo 2012
8. Huang YH, Yeh HZ, Chen GH, Chang CS, Wu CY, Poon SK, Lien HC, Yang SS. Endoscopic treatment for bleeding gastric varices by N-butyl-2-cyanoacrylate (Histoacryl) injection: long-term efficacy and safety. Gastrointest Endosc 2000;52:160-167.
9. Iwase H, Maeda O, Shimada M, Tsuzuki T, Peek RM Jr, Nishio Y, Ando T, Ina K, Kusugami K. Endoscopic ablation with cyanoacrylate glue for isolated gastric variceal bleeding. Gastrointest Endosc 2001;53:585-592.
10. D’Imperio N, Piemontese A, Baroncini D, Billi P, Borioni D, Dal Monte PP, Borrello P. Evaluation of undiluted Nbutyl- 2-cyanoacrylate in the endoscopic treatment of upper gastrointestinal tract varices. Endoscopy 1996;28:239-243.
11. Dhiman RK, Chawla Y, Taneja S, Biswas R, Sharma TR, Dilawari JB. Endoscopic sclerotherapy of gastric variceal bleeding with N-butyl-2-cyanoacrylate. J Clin Gastroenterol 2002;35:222-227.
12. Greenwald BD, Caldwell SH, Hespenheide EE, Patrie JT, Williams J, Binmoeller KF, Woodall L, Haluszka O. Nbutyl-2-cyanoacrylate for bleeding gastric varices: a United States pilot study and cost analysis. Am J Gastroenterol 2003;98:1982-1988.13. Lee YT, Chan FK, Ng EK, Leung VK, Law KB, Yung MY, Chung SC, Sung JJ. EUS-guided injection of cyanoacrylate for bleeding gastric varices. Gastrointest Endosc 2000;52:168-174.
14. Mumtaz K, Majid S, Shah H, Hameed K, Ahmed A, Hamid S, Jafri W. Prevalence of gastric varices and results of sclerotherapy with N-butyl 2 cyanoacrylate for controlling acute gastric variceal bleeding. World J Gastroenterol 2007;13:1247-1251.
15. Seewald S, Ang TL, Imazu H, Naga M, Omar S, Groth S, Seitz U, Zhong Y, Thonke F, Soehendra N. A standardized injection technique and regimen ensures success and safety of N-butyl-2-cyanoacrylate injection for the treatment of gastric fundal varices. Gastrointest Endosc 2008;68:447-464.


No hay comentarios:
Publicar un comentario