Aspectos epidemiológicos, clínicos y evolutivos (mortalidad) de una serie de pacientes con diagnóstico de hemorragia digestiva. Comentario editorial de los Dres. Jorge Neira y Cecilia De Filippo, (IntraMed Journal).
Dres. Dra Diana Latasa, Dr. Javier Montero, Dr. Carlos Lovesio
IntraMed Journal Abril 2013 Vol 2 Num 1
Introducción
La hemorragia digestiva (HD) es la pérdida de sangre que se origina en cualquier segmento del tubo digestivo, desde el esófago hasta el ano. Puede ser alta o baja según se produzca por encima o por debajo del ángulo de Treitz.1-5 La relevancia de esta entidad radica en su frecuencia y estrecha relación con la morbimortalidad de los pacientes que la padecen.5,6
Aunque la incidencia real global de las hemorragias digestivas no es fácil de determinar a pesar de la gran cantidad de reportes que se encuentran en la literatura médica, diversos estudios poblacionales estiman tasas anuales de HD alta (HDA) de 100 y 160 episodios por 100.000 habitantes al año, siendo más frecuente en la población masculina y añosa (la prevalencia aumenta con la edad).3-7 La tasa anual de hospitalización por HD alta en los Estados Unidos se estima en 165 admisiones por cada 100.000 habitantes, lo que se traduciría en más de 400.000 casos por año.5,8 Por su parte, en la HD baja (HDB) se estima una tasa anual de 20 hospitalizaciones por 100.000 habitantes, aunque su incidencia real no se conoce.7
La mortalidad de la HD depende de la causa e intensidad del sangrado, de las comorbilidades coexistentes del paciente y de la rapidez del abordaje diagnóstico y terapéutico.7 En términos generales, la mortalidad asociada a la HDA es del 5% a 10%,2-5,7 si bien puede alcanzar el 30% cuando es secundario a varices esofágicas.8 A diferencia de esta, la mortalidad de la HDB aguda es menos dramática alcanzando el 2,5%, si bien dicha tasa se incrementa drásticamente hasta el 23% cuando esta se desarrolla durante la hospitalización.4,7
Si bien la anemia aguda representa el hallazgo común en la HD tanto alta como baja, la presentación clínica típicamente varía según el sitio de la lesión sangrante. 4,7 La hematemesis y melena son características de la HDA mientras que la hematoquezia es el hallazgo semiológico más común de la HDB.5,6Debemos remarcar que la hematoquezia puede ser expresión de la HDA cuando la peristalsis intestinal está aumentada por la brusca irrupción de la sangre en el intestino delgado, como así también la melena puede ser expresión de un sangrado por debajo del ángulo de Treitz cuando el peristaltismo está reducido.6,7 La inestabilidad hemodinámica es más común en la HDA que en la baja (30% frente a 10%, respectivamente).4
Teniendo en cuenta la etiología y el manejo (aproximación diagnóstica y tratamiento) de los sangrados digestivos altos, las HDA se dividen en “HDA no variceales” (80 a 90%) y “HDA variceales” (10-20%)3. Los representantes más importantes del primer grupo son la enfermedad ulcerosa péptica (60%)2,3, la gastroduodenitis erosiva (12%) y el Síndrome de Mallory-Weiss (4-6%), mientras que en el segundo grupo el único representante es el sangrado por varices esofágicas.2,7,8
Por su parte, las causas de HDB varia según los reportes.4,9 Las dos causas más frecuentes de hemorragia digesiva baja son la hemorragia diverticular (15-40%) y las malformaciones vasculares o angiodisplasia (2-30%), seguido de la colitis de diversas causas (10-20%), tumores colónicos (10-15%) y menos frecuentemente, el sangrado de intestino delgado (2-9%).9
A pesar de los adelantos en las técnicas diagnósticas hasta un 8 a 12% de los casos de HD no se identifica el origen del sangrado.10 Esto ha llevado recientemente a introducir, a la ya clásica clasificación de HDA y HDB teniendo como punto de división el ángulo de Treitz, los términos HD oscura y oculta.1,5,10,11
La primera hace referencia a aquella hemorragia gastrointestinal clínicamente evidente, persistente y recurrente, sin origen identificado por medio de la evaluación endoscópica alta y baja 10,12 en cambio, la HD oculta es aquella situación clínica expresada por anemia ferropénica y/o sangre oculta en materia fecal sin evidencia macroscópica de sangrado en heces.11
En nuestro país existen pocos estudios volcados a la literatura que valoren los distintos aspectos de la hemorragia digestiva.13-15
Objetivos
Evaluar retrospectivamente los aspectos epidemiológicos, clínicos y evolutivos de una serie de pacientes con diagnóstico de HD ingresados a la Unidad de Terapia Intensiva de Sanatorio Parque de Rosario.
Materiales y Métodos
Se realizó un estudio descriptivo retrospectivo en el cual se analizaron las historias clínicas de los pacientes con diagnóstico de hemorragia digestiva alta y baja ingresados a la Unidad de Terapia Intensiva (UTI) del Sanatorio Parque entre el 1º de enero de 2007 al 30 de octubre de 2012. Las variables clínicas se recogieron en una base de datos diseñada exclusivamente para el estudio. Se excluyeron aquellos pacientes en los que no se pudo recabar los datos clínicos preestablecidos (demográficos, clínicos, ausencia de estudios endoscópicos).
Los datos obtenidos de las historia clínica fueron: edad; sexo; días de ingreso en UTI; antecedentes personales de hipertensión arterial (diagnóstico médico previo o uso de tratamiento antihipertensivo), diabetes mellitus (diagnóstico médico previo, al menos dos mediciones de glucemia basal superiores a 126 mg/dl, uso de medicación antidiabética), fibrilación auricular (previa o detectada durante el ingreso), enfermedad coronaria establecida (síndrome coronario agudo previo, angina de pecho estable, cirugía de revascularización miocárdica), insuficiencia cardíaca (fracción de eyección < 55%), insuficiencia renal crónica, ingesta de antiinflamatorios no esteroide (AINE) en los últimos 3 meses, alcoholismo (consumo de alcohol superior a 60 g/día), cirrosis (diagnóstico previo o realizado durante la internación), hemorragia digestiva previa; forma de presentación clínica (hematemesis, melena, hematoquezia, anemia aguda, shock hipovolémico hemorrágico, requerimiento de transfusión de hemoderivados); localización de la hemorragia digestiva (alta o baja); etiología de la hemorragia digestiva (ulcera gástrica, úlcera duodenal, gastritis erosiva, duodenitis, pólipo gástrico, cáncer gástrico, laceración de la mucosa esofagogástrica –síndrome de Mallory-Weiss–, várices esofágicas, angiodisplasia colónica, hemorragia diverticular, cáncer de colon, pólipo colónico, micelánea, hemorragia digestiva oculta, hemorragia digestiva oscura); estudio endoscópico realizado, tratamiento quirúrgico, utilización de sonda balón Sengstaken Blakemore; tratamiento médico; y, mortalidad.
Para la descripción de las variables continuas se utilizaron la media y desviación estándar cuando la distribución era normal, y la mediana y el rango de percentiles en caso contrario (la normalidad de una variable se comprobó mediante el test de Kolmogorov-Smirnov). Las variables categóricas se describieron mediante porcentajes. La comparación bivariada de grupos se realizó con los contrastes de t- Student (variables continuas normales), U-Mann-Whitney (variables continuas no normales) y χ2 (variables categóricas). Una p <0,05 fue considerada como estadísticamente significativa en todos los test. Para el análisis de datos utilizamos el programa estadístico SPSS 20.0 para Mac.
Resultados
Se evaluaron inicialmente 170 historias clínicas de casos que ingresaron con diagnóstico de hemorragia digestiva, de las cuales se apartaron 47 casos en base a los criterios de exclusión preestablecidos: en 41 casos no se realizó estudio endoscópico (23 no recibieron estudios endoscópicos por no considerarse necesario realizarlo de urgencia o tenían diagnóstico previo de patología sangrante, 11 presentaron signos clínicos aislados de hemorragia digestiva en el contexto de otro cuadro clínico, 6 pacientes se negaron a su realización, 1 por muerte en las primeras dos horas de admisión a UTI); en 6 casos solo se realizó endoscopia digestiva alta sin hallazgos patológicos interpretándose como hemorragia digestiva baja y difiriéndose el estudio diagnóstico. De forma definitiva, la muestra final quedó constituida por 123 episodios de hemorragia digestiva.
De los 123 casos, 94 (76,4%) fueron hombres y 29 (23,6%) mujeres. La edad promedio fue de 63,25 años con una desviación estándar de 16,19. Al realizar el análisis descriptivo de las características basales, hallamos que el 32,5% presentó el antecedente de HD previa, 26% había manifestado ingerir AINEs, el 22% presentó enfermedad hepática terminal (cirrosis) y un 18,7% recibía anticoagulación terapéutica con acenocumarol (el 96% por fibrilación auricular). Otros antecedentes fueron diabetes mellitus tipo 2 (21,1%), insuficiencia cardíaca (12,2%), insuficiencia renal crónica (4,9%) y EPOC (0,8%). En la Tabla 1 se muestran las características basales de los pacientes.
Tabla 1. Características demográficas y antecedentes personales de los pacientes con hemorragia digestiva
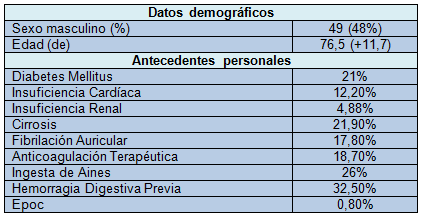
AINEs: antinflamatorios no esteroideos; EPOC enfermedad pulmonar obstructiva crónica.
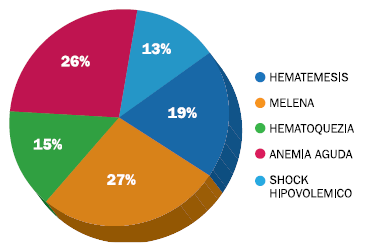
En relación a la forma de presentación clínica de la HD (ver figura 1), la melena, anemia aguda y hematemesis fueron las manifestaciones más comunes (77,2%, 74% y 54,4%, respectivamente), seguida de la hematoquezia (43%). El 35,8% se presentó con inestabilidad hemodinámica (shock hipovolémico/hemorrágico).
Figura 1. Formas de presentación clínica
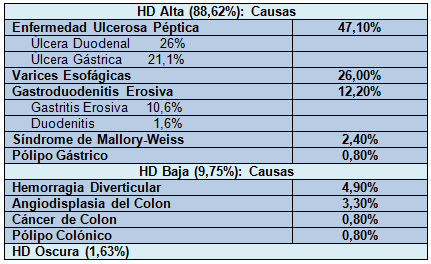
En cuanto a la localización del sangrado digestivo, 88,62% fueron HDA (n=109), 9,75% fueron HDB (n=12) y 1,63% presentó HD oscura (n=2). De todos los casos de HDA, 77 episodios fueron “HDA no variceal” (70,7%) y 32 “HDA de origen variceal” (29,3%).
El total de causas de HD fueron: úlcera duodenal (26%), úlcera gástrica (21,1%), várices esofágicas (26%), gastritis erosiva (10,6%), laceración de la mucosa esofagogástrica (2,4%), duodenitis (1,6%), y pólipo gástrico (0,8%). Entre las etiologías de HD baja encontramos la hemorragia diverticular (4,9), angiodisplasia colónica (3,3%), y cáncer de colon (0,8%). En la tabla 2 se muestran las causas de HD determinadas en nuestro estudio.
Tabla 2. Causas de Hemorragia Digestiva
El 46,7% recibió tratamiento endoscópico con adrenalina, polidocanol o bandas elásticas (según la causa), mientras que el 37,8% solo requirió tratamiento médico de soporte (hidratación, transfusiones de hemoderivados, supresión ácida intensa, etc.). El 9,8% requirió resolución quirúrgica del sangrado y en el 5,7% de los casos fue necesaria la colocación de una sonda balón Sengstaken Blakemore.
La mortalidad global por hemorragia digestiva en nuestro estudio fue del 10,6% (13 pacientes). Todas las muertes ocurrieron en el grupo de pacientes HDA, por lo que la mortalidad en esta población (n=109), fue del 11,9%. Las dos causas más frecuentes de muerte fueron la hemorragia variceal (5 pacientes) y la úlcera duodenal (5 pacientes) (ver Tabla 3).
Tabla 3. Causas de Muerte por Hemorragia Digestiva
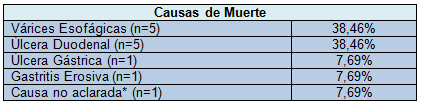
*Hematemesis masiva
Al analizar solo los grupos de HDA, la mortalidad por “HDA no variceal” la mortalidad fue del 10,38% (8 muertes de 77 pacientes), mientras que en el grupo de “HDA variceal” fue 15,6% (5 muertes en 32 ingresos por esta causa).
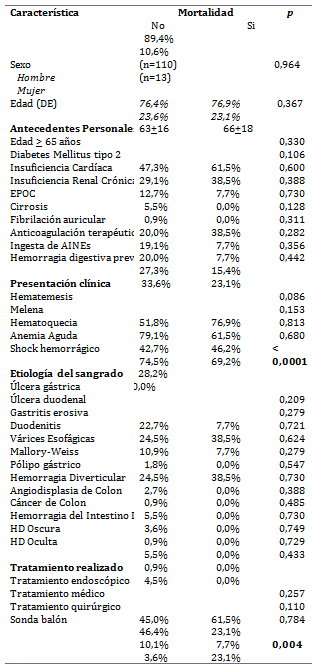
Al realizar el análisis univariado, encontramos que en el grupo de pacientes que fallecieron se detectó más frecuentemente el shock hemorrágico al momento del ingreso (100% de los pacientes que fallecieron frente al 28,2% de los que no presentaron dicho desenlace; p<0,0001), a la vez que recibieron más comúnmente tratamiento con la sonda balón por hemorragia incoercible (23,1 frente a 3,6% de pacientes que sobrevivieron; p<0,0001). Aunque las diferencias no alcanzaron la significancia estadística en el resto de variables analizadas, en el grupo de pacientes que murieron fue más común el antecedente de cirrosis (38,5% frente a 28% entre los que no murieron), la causa de sangrado variceal (38,5% frente a 24,5%) y enfermedad ulcerosa duodenal (38,5% frente a 24,5%), la expresión en forma de hematemesis (76,8% frente a 51,8%), la edad mayor de 65 años (61,5% frente a 47,3%), y por último, el porcentaje de tratamiento endoscópico (61,5% frente a 45%). No hubo diferencias en relación a la edad (en términos cuantitativos), sexo, otros antecedentes, causas de sangrado y tratamientos realizados (ver tabla 4).
Discusión
En nuestra serie de pacientes internados por hemorragia digestiva en Unidad de Terapia Intensiva del Sanatorio Parque observamos que la mayoría de los episodios fueron sangrados digestivos por encima del ángulo de Treitz; las causas más frecuentes fueron la enfermedad ulcerosa péptica gastroduodenal, seguida de la hemorragia variceal y gastroduodenitis erosiva, y por último, en el grupo de pacientes que fallecieron, la presentación clínica en forma de shock hemorrágico y la necesidad de utilización de la sonda balón de Sengstaken Blakemore fueron más comunes.
Los reportes disponibles sobre la frecuencia del origen del sangrado (alto o bajo) y las causas de la misma aportan información variable, lo que probablemente refleje las tendencias en el tiempo de las distintas causas de HD, las diferencias en el diseño de los estudios, las poblaciones estudiadas (adultos o ancianos, pacientes ingresados en servicios quirúrgicos o cuidados críticos, etc.), y tipo de procedimientos diagnósticos realizados.13-15
En nuestra serie de pacientes ingresados por hemorragia digestiva, el 88,6% de los pacientes presentaron un sangrado alto, siendo la HDB responsable sólo del 9,8%. Esto contrasta con otras serie de nuestro país donde la frecuencia de sangrado alto y bajo fueron similares; por ejemplo, en el trabajo de Di Pietro et al.15 el 55% de los casos presentó una HDA y el resto (45%) sangrado bajo.
Estas diferencias pueden justificarse principalmente por el tipo de población estudiada; en nuestro trabajo evaluamos pacientes ingresados a terapia intensiva probablemente más graves (incluso el 13% presentó shock hemorrágico como forma de presentación), que en otras series donde se tuvieron en cuenta pacientes ingresados en sala general 15 o solo el hallazgo endoscópico sin especificar lugar de internación.17
Las tres causas más frecuentes de HDA en nuestra serie fueron la enfermedad ulcerosa péptica (47,1%; úlcera duodenal 26% y úlcera gástrica 21,1%), la hemorragia variceal (26%) y la gastroduodenitis erosiva (12,2%). Otras causas fueron laceración de la mucosa esofagogástrica (2,4%) y un sangrado de pólipo gástrico (0,8%).
En la mayoría de las publicaciones, el 80% a 90% de sangrados digestivos altos de origen no variceal,5,9,18 lo que difiere con nuestros hallazgos donde el porcentaje de sangrado alto no variceal alcanzó el 70%, solo si contamos las HD altas. Estas diferencias podrían justificarse porque en nuestra institución se asisten un número importante de pacientes con patología hepática en fase terminal y porque estos pacientes suelen tener mayor repercusión hemodinámica lo que requiere su asistencia en cuidados intensivos.
En concordancia con la mayoría de los trabajos que hacen referencia a las HD bajas aguda 11,19, en nuestro estudio las causas más frecuentes fueron la hemorragia diverticular y la angiodisplasia colónica. Si bien el número de pacientes con esta patologías fue escaso, por tratarse de una cohorte de pacientes ingresados en UTI y estas, la mayoría de las veces son autolimitadas y no suelen ser graves, al considerar solo las HD bajas observamos que el 50% fueron de origen diverticular colónico y el 33% por angiodisplasia colónica. Estos hallazgos son concordantes con los de Zuckerman et al9 y Barnett & Messman.4
En nuestro estudio, la mortalidad global por HD fue del 10,6%, ocurriendo todos los casos en el grupo de pacientes con HD alta (11,9% si tenemos en cuenta solo este grupo). La mortalidad de la HD ha ido progresivamente disminuyendo en las últimas dos décadas debido al mejor abordaje diagnóstico y terapéutico de la enfermedad.
En un estudio comparativo de dos cohortes históricas de pacientes con HDA (período 1983-1985 y 2002-2004), Loperfido et al.17 demostraron que la mortalidad por esta entidad descendió de 17,1% a 8,2%, respectivamente. Actualmente la mortalidad por HDA se estima entre un 7 y 12%, pudiendo alcanzar el 30% o más en el caso de hemorragia por várices esofágicas (dependiendo de la intensidad del sangrado y/o severidad de la enfermedad hepática de base estimada por el escore de Child-Pugh).9,20
En nuestro estudio, la mortalidad por “HD alta no variceal” fue del 10,38%, similar a la publicada en la literatura, mientras que la tasa de muerte por “HD alta variceal” fue menor a ésta (15,6%), quizás debido a la rápida disponibilidad de tratamiento endoscópico de urgencia que existe en nuestra institución, fundamental para la resolución del cuadro. Debemos destacar que en el grupo de pacientes que falleció, todos presentaron shock hemorrágico al momento del ingreso, hecho que ocurrió solo en el 23% de los casos que sobrevivieron. Esto pone de relevancia el valor de este signo clínico y la importancia de una reanimación precoz adecuada en el manejo de estos enfermos.
A diferencia de los sangrados altos, la mortalidad por HD baja en la literatura es del 2,4%.10 En nuestro trabajo, no hubo muertes por HD baja atribuido quizás a que el número de pacientes fue escaso, la mayoría presentó un sangrado autolimitado y a que ningún caso de HDB ingresó con descompensación hemodinámica.
Cabe remarcar que este trabajo tiene algunas limitaciones, siendo la principal su carácter retrospectivo. Al no disponer en todas las historias de algunos datos, como escores de gravedad al momento del ingreso, respuesta inicial a la reanimación hemodinámica en pacientes inestables, aspectos relacionados con la limitación del esfuerzo terapéutico, número y tipo de transfusiones realizadas, etc. no pudimos identificar otros factores que pudieron haber influido en el desenlace final (mortalidad).
Conclusión
La intención de nuestro estudio fue mostrar las características demográficas, antecedentes personales de jerarquía, forma de presentación, causas y mortalidad en una serie de casos de hemorragia digestiva ingresados en una Unidad de Terapia Intensiva.
A pesar de las limitaciones del estudio ya mencionadas, podemos decir que la mayoría de los episodios fueron sangrados digestivos por encima del ángulo de Treitz, que las causas más frecuentes de HD fueron la enfermedad ulcerosa péptica gastroduodenal, seguida de la hemorragia variceal y la gastroduodenitis erosiva, y por último, que en el grupo de pacientes que fallecieron (10,6%), todos presentaron shock hemorrágico al momento del ingreso, lo que resalta la importancia de este signo clínico para detectar pacientes con mayor mortalidad.
Artículos relacionados
Referencias bibliográficas
1. Adler DG, Leighton JA, Davila RE, et al. ASGE guideline: The role of endoscopy in acute non-variceal upper-GI hemorrhage. Gastrointest Endosc. 2004; 60(4):497-504.
2. Baradarian R, Ramdhaney S, Chapalamadugu R et al. Early intensive resuscitation of patients with upper gastrointestinal bleeding decreases mortality. Am J Gastroenterol. 2004; 99(4):619-22.
3. Barkun AN, Bardou M, Kuipers EJ, et al. International consensus recommendations on the management of patients with nonvariceal upper gastrointestinal bleeding. Ann Intern Med. 2010; 152(2):101-13.
4. Barnert J, Messmann H. Management of lower gastrointestinal tract bleeding. Best Pract Res Clin Gastroenterol. 2008; 22(2):295-312.
5. Bini EJ, Cohen J. Endoscopic treatment compared with medical therapy for the prevention of recurrent ulcer hemorrhage in patients with adherent clots. Gastrointest Endosc. 2003; 58(5):707-14.
6. Blatchford O, Murray WR, Blachford M. A riskscore to predict need for treatment for upper- gastrointestinal haemorrhage. Lancet 2000; 356: 1318-21
7. Chait M. Lower gastrointestinal bleeding in the elderly. World J Gastrointest Endosc 2012; 2(5): 147-154
8. Cheung FK, Lau JY. Management of massive peptic ulcer bleeding. Gastroenterol Clin North Am. Jun 2009; 38(2):231-43.
9. Elmunzer BJ, Young SD, Inadomi JM, Schoenfeld P, Laine L. Systematic review of the predictors of recurrent hemorrhage after endoscopic hemostatic therapy for bleeding peptic ulcers. Am J Gastroenterol. 2008; 103(10):2625-32; quiz 2633.
10. Frattaroli FM, Casciani E, Spoletini D et al. Prospective study comparing multi-detector row CT and endoscopy in acute gastrointestinal bleeding. World J Surg. 2009; 33(10):2209-17.
11. Friedel D, Cappell M. Initial Management of Acute Upper Gastrointestinal Bleeding: From Initial Evaluation up to Gastrointestinal Endoscopy. Med Clin N Am 2008; 92: 491-509
12. Frodsham A, Berkmen T, Ananian C, Fung A. Initial experience using N-butyl cyanoacrylate for embolization of lower gastrointestinal hemorrhage. J Vasc Interv Radiol. 2009; 20(10):1312-9.
13. Fusaroli P, Grillo A, Zanarini S, Caletti G. Usefulness of a second endoscopic arm to improve therapeutic endoscopy in the lower gastrointestinal tract. Preliminary experience - a case series. Endoscopy. 2009; 41(11):997-1000.
14. Gayer C, Chino A, Lucas C al. Acute lower gastrointestinal bleeding in 1,112 patients admitted to an urban emergency medical center. Surgery. 2009; 146(4):600-6; discussion 606-7.
15. Guarner C, Santalo M, Gordillo J, et al. Trasnfusion Strategies for Acute Upper Gastrointestinal Bleeding. N Engl J Med 2013; 368: 11-21
16. Gupta R, Greer S. Lower Gastrointestinal Bleeding of unknown origin: tricks of the trade. Scandinavian Journal of Surgery 2010; 99: 103-105
17. Hadzibulic E and Govedarica S. Significance of Forrest classification, Rockall’s and Blatchford’s risk scoring system in prediction of rebleeding in peptic ulcer disease. Acta Medica Medianae 2007; 46 (4): 38-43
18. Helmut M, Jurgen B. Diagnosis and management of lower gastrointestinal bleeding. Gastroenterol and Hepatol 2009; 6: 637-646
19. Hu ML, Wu KL, Chiu KW, et al. Predictors of rebleeding after initial hemostasis with epinephrine injection in high-risk ulcers. World J Gastroenterol. 2010; 16(43):5490-5.
20. Kuipers E, Holster I. Management of acute nonvariceal upper gastrointestinal bleeding: Current policies and future perspectives. World J Gastroenterol 2012; 18 (11): 1202-1207
21. Lee S, Welman CJ, Ramsay D. Investigation of acute lower gastrointestinal bleeding with 16- and 64-slice multidetector CT. J Med Imaging Radiat Oncol. 2009; 53(1):56-63.
22. Leontiadis GI, Sharma VK, Howden CW. Proton pump inhibitor therapy for peptic ulcer bleeding: Cochrane collaboration meta-analysis of randomized controlled trials. Mayo Clin Proc. 2007; 82(3):286-96.
23. Miller FH, Hwang CM. An initial experience: using helical CT imaging to detect obscure gastrointestinal bleeding. Clin Imaging. Jul-Aug 2004; 28(4):245-51.
24. Neira J, Tisminetzky G. Trauma surgeon as intensivist: The Argentine vision. Curr Op Crit Care 2006; 12: 366-369
25. Neira, J Fondevila, C. Shock hemorrágico y coagulopatía en el paciente traumatizado. En PROATI. Ceraso, D; Chiappero, G (eds). Editorial Médica Panamericana. Decimosexto ciclo. Módulo 3. Buenos Aires, 2011. Pp. 159-204.
26. Palmer K, Higgins B, Kelsey A, et al. Management of acute upper gastrointestinal bleeding: summary of NICE guidance. BMJ 2012; 344: e3412 (1-5)
27. Pongprasobchai S, Nimitvilai S, Chasawat J, Manatsathit S. Upper gastrointestinal bleeding etiology score for predicting variceal and non-variceal bleeding. World J Gastroenterol. 2009; 15(9):1099-104
28. Rockall TA, Logan RF, Devlin HB, et al. Risk assessment after acute upper gastrointestinal haemorrhage. Gut 1996; 38: 316-21
29. Ryan MJ, Key SM, Dumbleton SA, MD, et al. Nonlocalized Lower Gastrointestinal Bleeding: Provocative Bleeding Studies with Intraarterial tPA, Heparin, and Tolazoline. J Vasc Interv Radiol. 2001; 12:1273-77.
30. Sabharwal R, Vladica P, Chou R, Law WP. Helical CT in the diagnosis of acute lower gastrointestinal haemorrhage. Eur J Radiol. 2006; 58(2):273-9.
31. Saltzman JR, Strate LL, Di Sena V et al. Prospective trial of endoscopic clips versus combination therapy in upper GI bleeding (PROTECCT-UGI bleeding). Am J Gastroenterol. 2005; 100(7):1503-8.
32. Sarin N, Monga N, Adams PC. Time to endoscopy and outcomes in upper gastrointestinal bleeding. Can J Gastroenterol. 2009; 23(7):489-93.
33. Scottish Intercollegiate Guidelines Network (SIGN). Management of acute upper and lower gastrointestinal bleeding. A national clinical guideline. (SIGN publication; no. 105). Edinburgh (Scotland): Scottish Intercollegiate Guidelines Network (SIGN); Sep 2008.
34. Silverstein FE, Gilbert DA, Tedesco FJ, Buenger NK, Persing J. The national ASGE survey on upper gastrointestinal bleeding. II. Clinical prognostic factors. Gastrointest Endosc. 1981; 27(2):80-93.
35. Stabile BE, Stamos MJ. Surgical management of gastrointestinal bleeding. Gastroenterol Clin North Am. 2000; 29(1):189-222.
36. Stephens JR, Hare NC, Warshow U, et al. Management of minor upper gastrointestinal haemorrhage in the community using the Glasgow Blatchford score. Eur J Gastroenterol Hepatol. 2009; 21 (12): 1340-6
37. Stollman N, Metz DC. Pathophysiology and prophylaxis of stress ulcer in intensive care unit patients. J Crit Care. 2005; 20(1):35-45.
38. Sung JJ, Tsoi KK, Ma TK, Yung MY, Lau JY, Chiu PW. Causes of mortality in patients with peptic ulcer bleeding: a prospective cohort study of 10,428 cases. Am J Gastroenterol. 2010; 105(1):84-9.
39. Wilkins T, Baird C, Pearson AN, Schade RR. Diverticular bleeding. Am Fam Physician. 2009; 80(9):977-83.
40. Wong Kee Song LM, Baron TH. Endoscopic management of acute lower gastrointestinal bleeding. Am J Gastroenterol. 2008; 103(8):1881-7.
41. Zuccaro G. Epidemiology of lower gastrointestinal bleeding. Best Pract Res Clin Gastroenterol. 2008; 22(2):225-32.


No hay comentarios:
Publicar un comentario