Eficacia de la administración profiláctica de antibioticos: Se investigó la eficacia de la administración profiláctica de ampicilina-sulbactam para la reducción de la incidencia de infección del sitio quirúrgico en pacientes con cáncer de mama obesas o con sobrepeso, sometidas a cirugía no reconstructiva.
Enlace: Ann Surg 2013; 257(1): 37-43
Resumen
|
Introducción
Aunque la cirugía de la mama es considerada como un procedimiento limpio, se halló que la incidencia de infección del sitio quirúrgico (ISQ) después de la misma, estaba bien por encima de lo esperable, siendo la complicación postoperatoria más común [1-4]. Estudios previos han reportado tasas de ISQ tan altas como el 33% después de cirugía por cáncer de mama [1,5-7].
Se consideró la prevención durante la cirugía por cáncer de mama, porque se demostró que la ISQ ocasiona mayor estadía hospitalaria, readmisión y costos adicionales, así como pobres resultados cosméticos [8]. Se hallaron muchos factores de riesgo asociados con un aumento en la incidencia de ISQ después de la cirugía por cáncer de mama, tales como edad avanzada, fuerte consumo de alcohol, tabaquismo actual o reciente, diabetes, biopsia abierta previa, mastectomía, transfusión, duración prolongada del drenaje, reconstrucción inmediata, radioterapia previa (RT) y quimioterapia (QT). Junto con esos, también se han reportado la obesidad y la ausencia o dosificación subóptima de profilaxis antibiótica al momento de la operación, como factores significativos de riesgo [4,9-11]. Un estudio previo reveló que el uso dirigido de antibióticos profilácticos en pacientes con esos factores de riesgo, redujo significativamente la incidencia de ISQ después de la cirugía mamaria [12], pero eso no ha sido confirmado aún por ningún ensayo controlado y randomizado.
Hasta ahora, se han reportado 3 ensayos randomizados diseñados para evaluar la eficacia de los antibióticos profilácticos, en los que el tamaño de las muestras está compuesto por pacientes promedio con cáncer de mamas sometidas a cirugía no reconstructiva. En todos esos ensayos, la incidencia de ISQ fue similar, tanto en el grupo con profilaxis, como en el grupo control [13-16].
A pesar de esos hallazgos en pacientes con cáncer, existe una tendencia a recomendar la administración de antibióticos profilácticos para la cirugía no reconstructiva de la mama, especialmente para aquellos que acarrean un riesgo alto de ISQ [17-19]. No obstante, la dosis óptima y el tipo de antibióticos, los efectos adversos y el costo-beneficio de la profilaxis no han sido aún determinados [17].
Dado que los estudios retrospectivos han revelado que la obesidad (o un elevado índice de masa corporal [IMC]), es uno de los determinantes significativos de la ISQ después de la cirugía por cáncer de mama, los autores de este trabajo diseñaron un estudio controlado y randomizado en donde se investigó la eficacia de la administración profiláctica de ampicilina-sulbactam para la reducción de la incidencia de ISQ, en pacientes con cáncer de mama obesas o con sobrepeso, sometidas a cirugía no reconstructiva. El objetivo primario del estudio fue comparar la incidencia de ISQ en pacientes con un IMC de 25 o mayor, que fueron asignadas al azar para recibir o no profilaxis. El costo-beneficio de la profilaxis antibiótica fue analizado como objetivo secundario.
Pacientes y métodos
Configuración y diseño del estudio
Ética
Se consideró la prevención durante la cirugía por cáncer de mama, porque se demostró que la ISQ ocasiona mayor estadía hospitalaria, readmisión y costos adicionales, así como pobres resultados cosméticos [8]. Se hallaron muchos factores de riesgo asociados con un aumento en la incidencia de ISQ después de la cirugía por cáncer de mama, tales como edad avanzada, fuerte consumo de alcohol, tabaquismo actual o reciente, diabetes, biopsia abierta previa, mastectomía, transfusión, duración prolongada del drenaje, reconstrucción inmediata, radioterapia previa (RT) y quimioterapia (QT). Junto con esos, también se han reportado la obesidad y la ausencia o dosificación subóptima de profilaxis antibiótica al momento de la operación, como factores significativos de riesgo [4,9-11]. Un estudio previo reveló que el uso dirigido de antibióticos profilácticos en pacientes con esos factores de riesgo, redujo significativamente la incidencia de ISQ después de la cirugía mamaria [12], pero eso no ha sido confirmado aún por ningún ensayo controlado y randomizado.
Hasta ahora, se han reportado 3 ensayos randomizados diseñados para evaluar la eficacia de los antibióticos profilácticos, en los que el tamaño de las muestras está compuesto por pacientes promedio con cáncer de mamas sometidas a cirugía no reconstructiva. En todos esos ensayos, la incidencia de ISQ fue similar, tanto en el grupo con profilaxis, como en el grupo control [13-16].
A pesar de esos hallazgos en pacientes con cáncer, existe una tendencia a recomendar la administración de antibióticos profilácticos para la cirugía no reconstructiva de la mama, especialmente para aquellos que acarrean un riesgo alto de ISQ [17-19]. No obstante, la dosis óptima y el tipo de antibióticos, los efectos adversos y el costo-beneficio de la profilaxis no han sido aún determinados [17].
Dado que los estudios retrospectivos han revelado que la obesidad (o un elevado índice de masa corporal [IMC]), es uno de los determinantes significativos de la ISQ después de la cirugía por cáncer de mama, los autores de este trabajo diseñaron un estudio controlado y randomizado en donde se investigó la eficacia de la administración profiláctica de ampicilina-sulbactam para la reducción de la incidencia de ISQ, en pacientes con cáncer de mama obesas o con sobrepeso, sometidas a cirugía no reconstructiva. El objetivo primario del estudio fue comparar la incidencia de ISQ en pacientes con un IMC de 25 o mayor, que fueron asignadas al azar para recibir o no profilaxis. El costo-beneficio de la profilaxis antibiótica fue analizado como objetivo secundario.
Pacientes y métodos
Configuración y diseño del estudio
Este estudio (Clinicaltrials.gov número NCT00356148) fue un ensayo de fase IV, randomizado, controlado, de eficacia en grupos paralelos. Fue diseñado para evaluar la eficacia de una única dosis profiláctica preoperatoria de ampicilina-sulbactam para reducir la incidencia de ISQ, en pacientes con cáncer de mama, obesas o con sobrepeso, sometidas a cirugía no reconstructiva. El ensayo fue configurado para identificar la superioridad de la profilaxis. Se testeó la hipótesis de que una política de administración profiláctica preoperatoria de ampicilina-sulbactam podría reducir la incidencia de ISQ en la cohorte descrita. El estudio se llevó a cabo en un hospital universitario terciario. Las asignaciones fueron ocultas para las pacientes y los observadores.
Ética
El protocolo del ensayo fue revisado y aprobado por el Institutional Ethics Committee de la Marmara University School of Medicine. Todas las mujeres enroladas brindaron su consentimiento informado por escrito antes de su inclusión en el ensayo.
Pacientes (criterio de elección y exclusión)
Todas las pacientes con cáncer de mama en estadio clínico I-II no recidivado que fueron programadas para cirugía no reconstructiva del cáncer en el Marmara University Hospital Breast Center, fueron consideradas elegibles para su inclusión. Sólo fueron incluidas aquellas pacientes que tenían un estado de salud de clase I o II de la clasificación de la American Society of Anesthesiologists (ASA) y que brindaron su consentimiento informado.
No se incluyeron en este estudio pacientes masculinos y, antes de la randomización, a aquellas mujeres con diagnóstico preoperatorio de carcinoma ductal in situ (CDIS), carcinoma localmente avanzado (estadio III) o cáncer de mama bilateral o metastásico; las que recibieron QT neoadyuvante, las que tenían planificado ser sometidas a cirugía reconstructiva inmediata; las que tenían antecedentes de alergia, hipersensibilidad, anafilaxia o reacción cruzada a los antibióticos beta-lactámicos o cefalosporinas; las que tenían inmunodeficiencia (diabetes mellitus no controlada, enfermedad renal crónica, enfermedad de Cushing, HIV, mala nutrición, niveles de albúmina sérica menores a 3 g, recuento de leucocitos menor a 500, recuento de linfocitos menor a 200, esplenectomía previa, antecedentes adicionales de cáncer diferente al cáncer de células basales/escamosas y cáncer cervical in situ, pérdida de más del 20% del peso corporal en los 6 meses previos, 3 ó más enfermedades crónicas asociadas y clase ASA III-IV); las que estaban recibiendo drogas inmunosupresoras (por ej., glucocorticoides); las que tenían una infección remota sincrónica, las que recibieron algún antibiótico en el mes previo, las que tenían antecedentes de haber sido sometidas a una operación de mama y/o axila (lumpectomía, mastectomía, disección axilar o biopsia del ganglio linfático centinela, excluyendo la biopsia abierta de mama) y aquellas que se negaron a brindar un consentimiento informado.
Las pacientes que recibieron QT, RT, cirugía adicional mamaria o axilar, y antibióticos por cualquier razón diferente al tratamiento de una ISQ, dentro de los 30 días después de la randomización, fueron excluidas del análisis final.
Asignación al azar / Grupos de estudio
No se incluyeron en este estudio pacientes masculinos y, antes de la randomización, a aquellas mujeres con diagnóstico preoperatorio de carcinoma ductal in situ (CDIS), carcinoma localmente avanzado (estadio III) o cáncer de mama bilateral o metastásico; las que recibieron QT neoadyuvante, las que tenían planificado ser sometidas a cirugía reconstructiva inmediata; las que tenían antecedentes de alergia, hipersensibilidad, anafilaxia o reacción cruzada a los antibióticos beta-lactámicos o cefalosporinas; las que tenían inmunodeficiencia (diabetes mellitus no controlada, enfermedad renal crónica, enfermedad de Cushing, HIV, mala nutrición, niveles de albúmina sérica menores a 3 g, recuento de leucocitos menor a 500, recuento de linfocitos menor a 200, esplenectomía previa, antecedentes adicionales de cáncer diferente al cáncer de células basales/escamosas y cáncer cervical in situ, pérdida de más del 20% del peso corporal en los 6 meses previos, 3 ó más enfermedades crónicas asociadas y clase ASA III-IV); las que estaban recibiendo drogas inmunosupresoras (por ej., glucocorticoides); las que tenían una infección remota sincrónica, las que recibieron algún antibiótico en el mes previo, las que tenían antecedentes de haber sido sometidas a una operación de mama y/o axila (lumpectomía, mastectomía, disección axilar o biopsia del ganglio linfático centinela, excluyendo la biopsia abierta de mama) y aquellas que se negaron a brindar un consentimiento informado.
Las pacientes que recibieron QT, RT, cirugía adicional mamaria o axilar, y antibióticos por cualquier razón diferente al tratamiento de una ISQ, dentro de los 30 días después de la randomización, fueron excluidas del análisis final.
Asignación al azar / Grupos de estudio
El IMC de todas las pacientes elegibles fue calculado de acuerdo con el índice Quetelet, en donde el peso corporal de la paciente, en kilogramos (kg), es dividido por el cuadrado de su altura en metros (m), el día anterior a la cirugía [20].
Las pacientes con un IMC de 25 o por encima, fueron categorizadas como sobrepeso u obesas y aquellas con un IMC menor de 25 fueron consideradas como normales (sanas). Las pacientes con un IMC de 25 o mayor fueron asignadas al azar, ya sea para el grupo de profilaxis o para el grupo control en una proporción de 1:1. La asignación de las pacientes se efectuó por simple randomización, usando una tabla de números al azar generada por computadora. Las pacientes en el grupo de profilaxis recibieron 1 gr de ampicilina-sulbactam en bolo endovenoso al momento de la inducción anestésica. Aquellas en el grupo control no recibieron ningún antibiótico. Las asignaciones fueron ocultas para las pacientes y los observadores. La lista de randomización generada por computadora fue preparada por un investigador no involucrado con el ensayo. Después de confirmarse la elegibilidad mediante la medición del IMC y de la provisión del consentimiento informado, un investigador no involucrado telefoneó al anestesiólogo a cargo de la paciente el día de la operación para enviarle la asignación.
Todas las pacientes con un IMC por debajo de 25 fueron mantenidas también en vigilancia por 30 días postoperatorios, como un grupo separado de estudio (rama de observación no randomizada; grupo con peso normal) sin darles ninguna profilaxis.
Las pacientes con un IMC de 25 o por encima, fueron categorizadas como sobrepeso u obesas y aquellas con un IMC menor de 25 fueron consideradas como normales (sanas). Las pacientes con un IMC de 25 o mayor fueron asignadas al azar, ya sea para el grupo de profilaxis o para el grupo control en una proporción de 1:1. La asignación de las pacientes se efectuó por simple randomización, usando una tabla de números al azar generada por computadora. Las pacientes en el grupo de profilaxis recibieron 1 gr de ampicilina-sulbactam en bolo endovenoso al momento de la inducción anestésica. Aquellas en el grupo control no recibieron ningún antibiótico. Las asignaciones fueron ocultas para las pacientes y los observadores. La lista de randomización generada por computadora fue preparada por un investigador no involucrado con el ensayo. Después de confirmarse la elegibilidad mediante la medición del IMC y de la provisión del consentimiento informado, un investigador no involucrado telefoneó al anestesiólogo a cargo de la paciente el día de la operación para enviarle la asignación.
Todas las pacientes con un IMC por debajo de 25 fueron mantenidas también en vigilancia por 30 días postoperatorios, como un grupo separado de estudio (rama de observación no randomizada; grupo con peso normal) sin darles ninguna profilaxis.
Procedimientos quirúrgicos y manejo de la herida
Todas las pacientes fueron hospitalizadas el día anterior a la cirugía. Después de la randomización, las pacientes fueron sometidas a la cirugía definitiva para el cáncer de mama, de acuerdo con la decisión preoperatoria.
Todas las operaciones fueron realizadas bajo anestesia general. Para todas las pacientes, la preparación de la piel se realizó usando una solución de povidona iodada. Las técnicas quirúrgicas para la mastectomía, cirugía conservadora de la mama (CCM), disección axilar (nivel I-II) y biopsia del ganglio linfático centinela (BGLC), se realizaron de acuerdo a estándar de cuidado. La BGLC se efectuó durante la noche de acuerdo con un protocolo, con técnica combinada (usando tinción azul y marcador radioactivo). Todas las incisiones mamarias fueron cerradas con suturas subcutáneas absorbibles y clips de piel. Los clips fueron removidos al 7º día postoperatorio. No se usaron prótesis mamarias. Los clips inertes fueron dejados en la cavidad quirúrgica en la CCM. No se administró RT intraoperatoria en ninguna de las pacientes. Todos los drenajes fueron removidos cuando el débito fue menor a 50 mL por día o finalmente al 7º día. Los seromas tardíos fueron aspirados utilizando una jeringa estéril de 10 mL, cuando fue necesario, después de la extracción del drenaje.
Monitoreo
Todas las operaciones fueron realizadas bajo anestesia general. Para todas las pacientes, la preparación de la piel se realizó usando una solución de povidona iodada. Las técnicas quirúrgicas para la mastectomía, cirugía conservadora de la mama (CCM), disección axilar (nivel I-II) y biopsia del ganglio linfático centinela (BGLC), se realizaron de acuerdo a estándar de cuidado. La BGLC se efectuó durante la noche de acuerdo con un protocolo, con técnica combinada (usando tinción azul y marcador radioactivo). Todas las incisiones mamarias fueron cerradas con suturas subcutáneas absorbibles y clips de piel. Los clips fueron removidos al 7º día postoperatorio. No se usaron prótesis mamarias. Los clips inertes fueron dejados en la cavidad quirúrgica en la CCM. No se administró RT intraoperatoria en ninguna de las pacientes. Todos los drenajes fueron removidos cuando el débito fue menor a 50 mL por día o finalmente al 7º día. Los seromas tardíos fueron aspirados utilizando una jeringa estéril de 10 mL, cuando fue necesario, después de la extracción del drenaje.
Monitoreo
Al egreso, las pacientes fueron claramente instruidas (con instrucciones orales y escritas) para contactar a los investigadores en el caso de problemas en la incisión dentro o después de los 30 días postoperatorios. Las heridas fueron inspeccionadas antes del egreso hospitalario y examinadas por profesionales ciegos en relación con la asignación, en la primera visita de seguimiento postoperatorio el día 7. Luego, un observador ciego en relación con el resultado del tratamiento (enfermera de infectología) monitoreó a todas las pacientes en los días postoperatorios 14, 21 y 30, mediante inspección directa.
La ISQ fue definida como las infecciones que ocurrían dentro de los 30 días postoperatorios con, al menos, 1 de los siguientes criterios [21]: a) drenaje purulento de la incisión, aún sin confirmación del laboratorio; b) organismos aislados de cultivos obtenidos asépticamente de fluidos o tejidos de la incisión; c) al menos uno de los siguientes signos o síntomas de infección: dolor, edema localizado, enrojecimiento o calor e incisión superficial abierta deliberadamente por el cirujano, a menos que tuviera un cultivo negativo; y d) diagnóstico de ISQ por el cirujano o el médico de cabecera. Se excluyeron los abscesos de las suturas.
El momento en que apareció la ISQ fue medido desde el final de la operación hasta que se descubrió el primer signo de infección. Se tomaron cultivos de fluidos y/o hisopados de las heridas de las pacientes con ISQ.
Resultados
- Medición de los resultados primarios
La ISQ fue definida como las infecciones que ocurrían dentro de los 30 días postoperatorios con, al menos, 1 de los siguientes criterios [21]: a) drenaje purulento de la incisión, aún sin confirmación del laboratorio; b) organismos aislados de cultivos obtenidos asépticamente de fluidos o tejidos de la incisión; c) al menos uno de los siguientes signos o síntomas de infección: dolor, edema localizado, enrojecimiento o calor e incisión superficial abierta deliberadamente por el cirujano, a menos que tuviera un cultivo negativo; y d) diagnóstico de ISQ por el cirujano o el médico de cabecera. Se excluyeron los abscesos de las suturas.
El momento en que apareció la ISQ fue medido desde el final de la operación hasta que se descubrió el primer signo de infección. Se tomaron cultivos de fluidos y/o hisopados de las heridas de las pacientes con ISQ.
Resultados
- Medición de los resultados primarios
• Incidencia de la ISQ en los grupos asignados al azar, compuestos de pacientes con un IMC de 25 o mayor; tasa de riesgo (TR) comparando la tasa de ISQ en el grupo de profilaxis con la tasa en el grupo control, con un intervalo de confianza (IC) del 95%.
- Medición de los resultados secundarios
- Medición de los resultados secundarios
• Incidencia de ISQ en pacientes con un IMC menor de 25 (grupo de peso normal); TR comparando la tasa de ISQ en el grupo control (pacientes con IMC de 25 o mayor que no recibieron antibióticos) con la tasa en grupo de peso normal.
• Momento de desarrollo de la ISQ en pacientes con un IMC de 25 o mayor.
• Resultado de los cultivos (microorganismos) en pacientes con un IMC de 25 o mayor.
• Reacciones adversas debidas a los antibióticos.
• Costo en cada grupo randomizado.
Datos
La edad de las pacientes, IMC, antecedentes de tabaquismo, clase ASA, tipo de biopsia, intervalo entre la biopsia y la cirugía, estadio clínico (cáncer), tipo y duración de la cirugía, complicaciones operatorias y duración de la estadía hospitalaria, fueron registrados para una comparación con los datos basales.
Los datos sobre costos para todas las readmisiones, visitas hospitalarias ambulatorias, uso adicional de antibióticos y manejo de la herida relacionado con la ISQ, en las pacientes con IMC de 25 o mayor, fueron recolectados prospectivamente de los registros de facturación del hospital. Sólo los costos involucrados con el diagnóstico (hisopados y cultivos) y tratamiento de la ISQ en pacientes con IMC de 25 o mayor, así como el uso profiláctico de los antibióticos, fueron analizados para la comparación. Los costos relacionados con el tratamiento para el cáncer de mama fueron excluidos del análisis. Los costos en liras turcas (LT) fueron convertidos en dólares norteamericanos (USD) y en euros (EUR) de acuerdo con las tasas de cambio válidas en marzo de 2010.
Cálculo del tamaño de la muestra y análisis estadístico
Los datos sobre costos para todas las readmisiones, visitas hospitalarias ambulatorias, uso adicional de antibióticos y manejo de la herida relacionado con la ISQ, en las pacientes con IMC de 25 o mayor, fueron recolectados prospectivamente de los registros de facturación del hospital. Sólo los costos involucrados con el diagnóstico (hisopados y cultivos) y tratamiento de la ISQ en pacientes con IMC de 25 o mayor, así como el uso profiláctico de los antibióticos, fueron analizados para la comparación. Los costos relacionados con el tratamiento para el cáncer de mama fueron excluidos del análisis. Los costos en liras turcas (LT) fueron convertidos en dólares norteamericanos (USD) y en euros (EUR) de acuerdo con las tasas de cambio válidas en marzo de 2010.
Cálculo del tamaño de la muestra y análisis estadístico
El tamaño de la muestra fue calculado para las pacientes con un IMC de 25 o mayor, que fueron programadas para ser randomizadas para 1 de las 2 ramas del estudio. Ello fue calculado en 360 pacientes (180 para cada grupo), para tener un poder estadístico del 90% con 0,05 para un puntaje significativo de dos lados, basado en la asunción de que la profilaxis antibiótica reduce la tasa de ISQ desde un 10% (promedio en pacientes obesas) [9,12] a un 2% (valor esperado para la cirugía clasificada como limpia con/sin profilaxis antibiótica) [11,12,15,22]. Los datos de las pacientes randomizadas fueron analizados sobre una base de intención de tratamiento. No se realizó un análisis intermedio. El registro y análisis estadístico de los datos fue realizado con el programa SPSS, versión 11.0.0. La incidencia de la ISQ fue comparada entre los grupos (grupo profilaxis vs grupo control y grupo control vs grupo de peso normal) usando la prueba de 2 de dos colas. La tasa de riesgo (TR) y los índices de confianza (IC) del 95% fueron reportados. El número de pacientes con necesidad de tratamiento fue calculado por comparación entre los grupos de profilaxis y control. Las pruebas de Chi cuadrado o exacta de Fisher fueron usadas para comparar las variables categóricas, mientras que las pruebas independientes t de dos muestras fueron empleadas para las variables continuas, en una comparación basal de variables en las ramas randomizadas. Los datos sobre costos en los grupos de profilaxis y control fueron comparados con pruebas independientes t de dos muestras. Las variables continuas fueron brindadas como medias (± desvío estándar [DE]). Todas las pruebas estadísticas fueron de 2 lados y el valor de P menor de 0,05 fue considerado como significativo.
Resultados
Detalles de la cohorte
Resultados
Detalles de la cohorte
Un total de 649 pacientes con cáncer de mama primario, no recidivado, fueron admitidos en el Marmara University Hospital Breast Cancer, entre octubre de 2003 y marzo de 2010. De esos, 128 pacientes no fueron elegibles por las siguientes razones: 4 eran hombres, 28 tenían un diagnóstico inicial de CDIS, 13 tenían enfermedad localmente avanzada, 31 recibieron quimioterapia neoadyuvante, 6 tenían una cirugía estética previa de la mama, 5 tenían cáncer bilateral, 4 tenían planificada una reconstrucción inmediata, 2 tenían requerimiento antibiótico para profilaxis por enfermedad cardíaca, 1 tenía caquexia, 1 tenía una infección remota coexistente, 1 estaba recibiendo una droga inmunosupresora, 1 tenía enfermedad de Cushing concomitante, 1 declinó la participación y a 30 no se les solicitó que entraran en el ensayo. Entre las 521 pacientes elegibles, 372 tenían un IMC de 25 o mayor y fueron randomizadas en 2 ramas: 189 y 183 pacientes fueron asignadas para el grupo de profilaxis y el grupo control, respectivamente. Tres pacientes fueron excluidas del análisis primario porque fueron sometidas a una segunda cirugía dentro del mes: 2 en el grupo de profilaxis y 1 en el de control. Por lo tanto, 369 pacientes con un IMC de 25 o mayor fueron incluidas en el análisis final, de acuerdo con el principio de intención de tratamiento: 187 en el grupo de profilaxis y 182 en el grupo de control. Una paciente en el grupo de profilaxis no recibió antibióticos según el protocolo. Ninguna paciente en el grupo control violó el protocolo del ensayo.
Junto con las pacientes randomizadas, 149 pacientes elegibles con un IMC de menos de 25, fueron seguidas sin profilaxis antibiótica (grupo de peso normal). En esa cohorte separada, 4 pacientes fueron sometidas a una segunda operación dentro de los 30 días postoperatorios y en una paciente el informe anatomopatológico definitivo fue benigno. Ninguna paciente en ese grupo recibió antibióticos durante el período de seguimiento de 30 días. En consecuencia, 144 pacientes en el grupo de peso normal fueron incluidas en el análisis final.
Dos cirujanos experimentados, cada uno con una carga anual global de, al menos, 50 casos de cáncer de mama, realizaron o supervisaron todas las operaciones. Las técnicas quirúrgicas y el abordaje clínico global (incluyendo BGLC) de los casos, se mantuvieron similares durante todo el período del estudio. Ninguna de las pacientes, en cualquiera de las 2 ramas del estudio o de aquellas en el grupo de peso normal, fue perdida durante el seguimiento alejado hasta el día 30 del postoperatorio. Ninguna paciente recibió QT adyuvante dentro del período de seguimiento.
Junto con las pacientes randomizadas, 149 pacientes elegibles con un IMC de menos de 25, fueron seguidas sin profilaxis antibiótica (grupo de peso normal). En esa cohorte separada, 4 pacientes fueron sometidas a una segunda operación dentro de los 30 días postoperatorios y en una paciente el informe anatomopatológico definitivo fue benigno. Ninguna paciente en ese grupo recibió antibióticos durante el período de seguimiento de 30 días. En consecuencia, 144 pacientes en el grupo de peso normal fueron incluidas en el análisis final.
Dos cirujanos experimentados, cada uno con una carga anual global de, al menos, 50 casos de cáncer de mama, realizaron o supervisaron todas las operaciones. Las técnicas quirúrgicas y el abordaje clínico global (incluyendo BGLC) de los casos, se mantuvieron similares durante todo el período del estudio. Ninguna de las pacientes, en cualquiera de las 2 ramas del estudio o de aquellas en el grupo de peso normal, fue perdida durante el seguimiento alejado hasta el día 30 del postoperatorio. Ninguna paciente recibió QT adyuvante dentro del período de seguimiento.
Comparación básica de los grupos randomizados (Profilaxis vs Control)
Los grupos estuvieron bien apareados por edad, IMC, antecedentes de tabaquismo, clase ASA, intervalo entre la biopsia tisular y la randomización, estadio clínico del cáncer, tipo de cirugía mamaria y axilar, tiempo operatorio, estadía hospitalaria y complicaciones postoperatorias diferentes de la ISQ. No obstante, las pacientes en el grupo control tuvieron significativamente una mayor frecuencia de biopsias abiertas que aquellas en el grupo de profilaxis (16% vs 6%, respectivamente; P = 0,004; Tabla 1).
• TABLA 1: Comparación de las características de las pacientes en los grupos de estudio asignados

Tasa de ISQ
- Grupo de profilaxis vs grupo control
Según el principio de análisis por intención de tratamiento, se observó que 9 ISQ (4,8%) se desarrollaron en el grupo de profilaxis, comparado con 25 (13,7%) en el grupo de control (TR 0,35; 95% IC: 0,17-0,73; P = 0,002). Todas las ISQ fueron superficiales. El “número que necesitó tratamiento” reveló que cuando 11 pacientes con IMC de 25 o mayor recibieron antibióticos profilácticos, 1 ISQ fue prevenida. Todas las ISQ, en ambas ramas, se desarrollaron en pacientes con un IMC de 30 o mayor.
- Grupo control vs grupo de peso normal
La ISQ se desarrolló en 5 pacientes con peso normal (3,5%). Todas fueron superficiales. Las pacientes en el grupo control (13,7%) tuvieron significativamente más ISQ cuando se las comparó con aquellas en el grupo de peso normal (TR 3,96; 95% IC: 1,55-10,08; P = 0,0007).
Momento del desarrollo de la ISQ
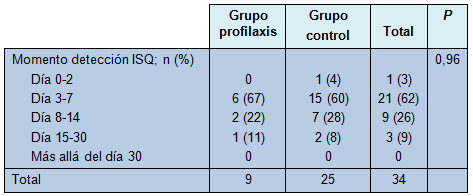
Las ISQ se desarrollaron después del egreso, excepto en 1 caso. La mayoría de las infecciones (65%) fueron diagnosticadas dentro de la primera semana postoperatoria. El momento de aparición de la ISQ fue similar en ambas ramas randomizadas (P = 0,96; Tabla 2).
• TABLA 2: Tiempo transcurrido hasta la detección de la ISQ en los grupos de estudio asignados
Resultados de los cultivos
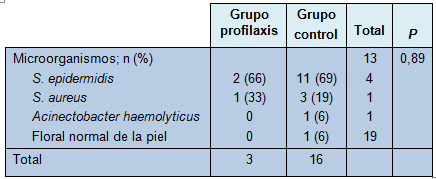
Las muestras de 19 ISQ (56%) que se desarrollaron en pacientes con un IMC de 25 o mayor, fueron cultivadas. El Staphylococcus epidermidis (n = 13; 68%) fue el microorganismo más frecuentemente aislado. Otros aislamientos contuvieron Staphylococcus aureus (n = 4; 21%), Acinectobacter haemolyticus (n = 1; 5%) y flora normal de la piel (n = 1; 5%). Los aislamientos fueron similares en ambas ramas (P = 0,89; Tabla 3).
• TABLA 3: Resultados de los cultivos en los grupos de estudio asignados
Reacciones adversas
No se observaron reacciones adversas en las pacientes que recibieron antibióticos.
Análisis de los costos
Ninguna paciente necesitó ser readmitida en el hospital. Todas las pacientes con ISQ se recuperaron y estuvieron completamente curadas mediante manejo de la ISQ y régimen de antibióticos orales, de manera ambulatoria.
Las pacientes en el grupo control tuvieron costos relacionados con la ISQ significativamente más altos (29,98 LT o 20,26 USD o 14,84 EUR) cuando se las comparó con aquellas en el grupo de profilaxis (12,55 (LT o 8,48 USD o 6,21 EUR; P = 0,007).
Discusión
En este estudio, los autores hallaron que el IMC de 25 o mayor aumentó el riesgo de desarrollo de ISQ en, aproximadamente, 4 veces, en las pacientes sometidas a cirugía por cáncer de mama. Asimismo, también encontraron que la administración profiláctica preoperatoria de 1 g de ampicilina-sulbactam disminuyó significativamente la tasa de ISQ, después de la cirugía por cáncer de mama en pacientes con un IMC de 25 o mayor. La profilaxis redujo la tasa de ISQ en un 65%. Las tasas de ISQ en cada rama no revelaron un cambio significativo a través del período en estudio. Se encontró que el uso de antibióticos profilácticos fue costo-efectivo en esa cohorte. Sin embargo, los resultados de este estudio no pueden ser reflejados a cada paciente con cáncer de mama, porque el protocolo incluyó solamente a aquellas con un IMC de 25 o mayor.
Hasta donde llega el conocimiento de los autores, este es el primer estudio que reporta el impacto de los antibióticos profilácticos sobre la incidencia de ISQ y su costo-beneficio, en un grupo predefinido de pacientes con cáncer de mama, con una muestra de tamaño adecuado. Aunque configuraron el estudio para analizar los datos sobre la base de una intención de tratamiento, la violación del protocolo fue prácticamente nula. Por lo tanto, no se realizaron análisis adicionales por el protocolo. Además, la tasa de deserción fue pequeña, debido a la escasa pérdida en el seguimiento alejado.
Dado que el tamaño calculado de la muestra apuntó a aquellas pacientes con IMC de 25 o mayor, la admisión de las mismas tomó 6 ½ años. Aunque la carga anual de nuevos casos de cáncer de mama fue de aproximadamente 100, el estudio se prolongó por los estrictos criterios de exclusión y la exclusión de la randomización de aquellas pacientes con un IMC menor de 25. No obstante, las técnicas usadas para el manejo de las pacientes (incluyendo la BGLC) fueron mantenidas iguales a lo largo de todo el período del estudio. Otro hallazgo poco probable de este estudio fue que bastante más de la mitad de las pacientes fue sometida a mastectomía, a pesar de tener un cáncer en estadio temprano. Sin embargo, eso demostró que las pacientes turcas con cáncer de mama prefieren ser sometidas a mastectomía en mayor proporción que otras mujeres. Las mujeres de más edad y aquellas con más de 1 hijo, antecedentes de lactancia y un miembro de la familia con cáncer de mama, eligen la mastectomía en lugar de la CCM [23]. Por lo tanto, las discrepancias entre sociedades pueden explicar la alta tasa de mastectomía en esta cohorte.
Uno de los inconvenientes del presente estudio fue hallar una diferencia relacionada con los tipos de biopsia entre las ramas asignadas. Aunque todas las variables fueron similares, las pacientes en el grupo control fueron sometidas significativamente a más biopsias abiertas. Como el estudio fue diseñado como de tipo randomizado, los autores asumieron que cada factor de confusión diferente al uso de los antibióticos se distribuiría en cada grupo con igual peso. Debido a su diseño prospectivo randomizado, los autores piensan que el hallazgo de biopsias por resección más común en uno de los grupos, debería ser considerado como fortuito y no como un desvío. Sin embargo, dado que no pueden excluir el impacto del tipo de biopsia como un factor de riesgo, esa diferencia podría resultar en una tasa alta de ISQ en el grupo control. No obstante, un estudio prospectivo halló que el tipo de biopsia no es un factor significativo de riesgo para el desarrollo de la ISQ en la cirugía por cáncer de mama [11].
Aunque todos los cánceres ocultos planeados para tratamiento con CCM fueron localizados en el mismo día, mediante la técnica de colocación – controlada con imágenes – de un alambre guía, los autores no realizaron una comparación de línea de base para esa variable, debido a la pérdida de datos. Eso puede ser considerado como uno de los inconvenientes del estudio, porque podría tener también un impacto sobre la tasa de ISQ. Las pacientes fueron admitidas en el hospital el día previo a la cirugía, de acuerdo con las regulaciones del hospital y el protocolo del estudio. Además, el bienestar de las pacientes fue determinado por la duración de la estadía hospitalaria postoperatoria. Aunque fue similar y menor a 2 días en ambos grupos, la duración media de la estadía hospitalaria fue de más de 1 día en todas las cohortes. Eso refleja el hecho de que la mayoría de las cirugías no fueron casos de 1 día, lo que también podría haber tenido un efecto sobre la alta tasa de ISQ que se observó en el grupo control.
Aunque la cirugía del cáncer de mama es considerada como una cirugía “limpia” en la que la tasa esperada de ISQ es de alrededor del 1,5% [22], las observaciones después de la cirugía mamaria revelaron tasas más altas que las esperables [1,5-7]. Recientemente, 2 meta-análisis revisaron el efecto de los antibióticos profilácticos sobre la incidencia de ISQ después de la cirugía por cáncer de mama [17,18]. En esos análisis, se revisaron 7 ensayos prospectivos en donde se evaluaba la eficacia de la profilaxis antibiótica y se la comparaba con su no uso o con placebos [11,13-16,24,25], Ambos meta-análisis reportaron que la profilaxis redujo significativamente la incidencia de ISQ en pacientes que fueron sometidas a cirugía mamaria no reconstructiva, aunque no se halló una reducción significativa de la incidencia de la ISQ en ninguno de los 7 ensayos. Además, una revisión reciente basada en evidencia, concluyó que los antibióticos profilácticos pueden ser considerados en pacientes sometidas a cirugía mamaria sin reconstrucción inmediata, con un nivel “2” de evidencia y un grado “B” de recomendación [19].
Entre esos 7 ensayos, 3 incluyeron sólo a aquellas pacientes que tuvieron cirugía por cáncer de mama sin reconstrucción [13,15,16]. Los otros 4 ensayos incluyeron pacientes diferentes de las de cáncer de mama y procedimientos que involucraban cirugías estéticas, operaciones solamente axilares o menores, tales como la biopsia por resección y microdisectomía [11,14,24,25]. Además, entre aquellos que incluyeron sólo pacientes con cáncer de mama, Wagman y col. [13] y Chow y col. [15], administraron antibióticos profilácticos tanto antes como después de la cirugía. Sólo Gupta y col. [16], enrolaron pacientes con cáncer de mama que fueron sometidas a cirugía no reconstructiva y a las que se les brindó profilaxis antibiótica. Sin embargo, mostraron que 1,2 g preoperatorios de clavulanato de amoxicilina no redujo la incidencia de ISQ. No obstante, el tamaño de la muestra no tenía suficiente poder estadístico y el análisis no se basó en una intención de tratamiento.
En todos los ensayos previos, las pacientes con cáncer de mama fueron randomizadas sin tener en cuenta su IMC. De acuerdo con la definición del IMC, las personas son clasificadas dentro de 1 de 3 categorías: peso normal adecuado (IMC < 25), sobrepeso (25 ≤ IMC < 30) u obesidad (IMC ≥ 30) [26]. Estudios recientes encontraron que la obesidad o tener un IMC por encima del normal, aumenta significativamente el riesgo de ISQ en las pacientes con cáncer de mama [4,9,11]. Por lo tanto, los autores del presente trabajo consideraron al IMC como un factor principal de estratificación para la randomización. Consideraron como un factor alto de riesgo para la ISQ el tener un IMC de 25 o mayor y asignaron randomizadamente sólo a esas pacientes en las ramas del ensayo. El uso dirigido de profilaxis antibiótica en esas pacientes con alto riesgo relacionado con la ISQ, fue la estrategia principal en el presente ensayo. Los hallazgos revelaron también que las pacientes con un IMC de 25 o mayor tuvieron 4 veces más probabilidad de desarrollar una ISQ. Por lo tanto, consideran que el presente estudio fue único en lo que atañe a tamaño de la muestra, criterios de exclusión y pre-requisitos de randomización, que incluyó sólo a aquellas pacientes con un IMC de 25 o mayor. También se excluyeron a aquellas pacientes que ya tenían predisposición para la ISQ. Por lo tanto, tuvieron la posibilidad de evaluar el impacto de la profilaxis exclusivamente en pacientes con un alto IMC.
Los autores decidieron usar la ampicilina-sulbactam como droga de elección para la profilaxis, tanto por su efectividad como por la perspectiva del costo. La ampicilina-sulbactam fue elegida debido a su vida media y a su actividad conocida contra el S. aureus y el S. epidermidis, bacteria que demostró ser la más comúnmente aislada en los sitios de cirugía de mama infectados [10,11,27]. Junto con esos datos, los hallazgos del presente estudio también revelaron que el 89% de los microorganismos aislados de las infecciones fueron S. epidermidis o S. aureus. En otros ensayos prospectivos randomizados, los antibióticos elegidos para la profilaxis fueron la azitromicina, cefonicida, claritromicina, amoxicilina-ácido clavulánico, flucloxacilina y cefazolina, todos conocidos como efectivos sobre las bacterias Gram-positivas [11,13-16,24,25]. Como estudios recientes también revelaron que entre un tercio y la mitad de los cultivos de las pacientes con ISQ, después de cirugía mamaria, contienen también bacterias Gram-negativas, la ampicilina-sulbactam parece ser una buena elección, dada su cobertura contra los Gram-negativos [9,27]. Además, desde la perspectiva de los costos, la ampicilina-sulbactam fue recomendada como una de las mejores opciones [27].
Los autores diseñaron una tercera rama del estudio sin randomización, en la que las pacientes con IMC menor de 25 (grupo de peso normal) fueron seguidas sin recibir profilaxis, para compararlas con aquellas con un IMC de 25 o mayor. Un total de 3,5% de las pacientes desarrolló ISQ en ese grupo de bajo riesgo. Como resultado primario del ensayo, se halló que la administración de 1 dosis de 1 g de ampicilina-sulbactam, resultó en una reducción significativa de la incidencia de ISQ en pacientes con IMC de 25 o mayor. La profilaxis disminuyó la tasa de ISQ desde el 13,7% hasta el 4,8%, lo que es cercano a lo que encontraron en el grupo de peso normal. La reducción absoluta del riesgo fue del 8,9%. En otros términos, 11 pacientes necesitaron recibir antibióticos profilácticos para prevenir 1 ISQ. Vale la pena señalar que todas las ISQ, en ambas ramas, se desarrollaron en pacientes con un IMC de 30 o más. Por lo tanto, el impacto de la profilaxis en pacientes con un IMC de 25 o mayor, pero menor de 30, podría ser cuestionable. De acuerdo con los datos de este ensayo, existe evidencia indirecta de que no habría una indicación para el uso de antibióticos profilácticos en esas pacientes.
Cuatro ensayos prospectivos, aunque no bridaron datos en relación con el rango, han reportado una media o mediana del comienzo de la infección. En esos ensayos, la media o la mediana del tiempo de comienzo de la ISQ fue reportada entre 9,6 y 17,7 días, lo que fue similar en los grupos de profilaxis y control del presente estudio [11,13,16,24]. En el mismo, cerca de dos tercios de las infecciones se desarrolló dentro de la primera semana después de la cirugía. No ocurrieron ISQ más allá del 30º día postoperatorio. El momento de aparición del la ISQ fue similar en ambas ramas asignadas del ensayo. En consecuencia, la postergación de la infección no ocurre cuando se emplea la profilaxis.
Los autores no observaron ningún evento adverso debido al uso de la ampicilina-sulbactam en su ensayo. Del mismo modo, 5 estudios previos tampoco reportaron eventos adversos en todas sus cohortes [11,13,14,24]. Sólo 1 estudio prospectivo reportó reacciones adversas con el uso de amoxicilina-ácido clavulánico en su cohorte, sin especificación. No obstante, las incidencias fueron similares en los grupos con profilaxis y control [16]. Por lo tanto, parece que es seguro el uso de antibióticos, incluyendo la ampicilina-sulbactam, para la profilaxis durante la cirugía por cáncer mamario.
Además de la perspectiva de una eficacia física de la droga y del daño, también es importante evaluar si la costo-efectividad de la profilaxis justifica su uso. Hasta donde llega el conocimiento de los autores de este trabajo, existe sólo 1 estudio previo publicado, que efectuó una comparación del costo-beneficio de la profilaxis antibiótica en grupos randomizados. Bold y col. [14], hallaron que el costo promedio por paciente fue de 49,80 USD en el grupo con profilaxis antibiótica y de 364,87 USD en el grupo control. De manera similar que en el presente estudio, esos autores calcularon sólo el costo adicional de la atención de la herida y el tratamiento relacionado con la ISQ. No incluyeron el costo de la operación primaria por el cáncer y el relacionado con la estadía hospitalaria. Cálculos similares de costos fueron reportados por otros autores. Reilly y col. [8] y Olsen y col. [28], calcularon 359 libras inglesas y 409 USD, respectivamente, como el costo medio atribuible al manejo de la ISQ después de la cirugía mamaria. En el presente ensayo, los autores también hallaron que el costo de la profilaxis es significativamente menor que el costo de no usarla. Aunque en Turquía los costos relacionados con la atención de la salud parecen ser muchos menores que en los países de Europa y los EEUU, el costo medio encontrado fue de 20,26 USD en las pacientes que no recibieron profilaxis antibiótica, mientras que fue de 8,48 USD para aquellas que si la recibieron. Además, la razón para ese relativamente bajo costo en ambos grupos podría haber resultado del hecho de que, en este estudio, ninguna paciente fue hospitalizada para el manejo de su ISQ. En su estudio, Bold y col. [14] responsabilizaron por el alto costo a la alta tasa de readmisión en las pacientes que desarrollaron ISQ. Asimismo, Olsen y col [28], calcularon el costo incluyendo el asociado con la duración adicional de la estadía hospitalaria.
Conclusión
Conclusión
Como conclusión, se halló que tener un IMC de 25 o mayor fue un factor significativo de riesgo para el desarrollo de una ISQ después de la cirugía en las pacientes con cáncer de mama. La administración profiláctica de 1 g de ampicilina-sulbactam en la cirugía, disminuyó la incidencia de ISQ en un 65% en esas pacientes con alto riesgo de ISQ. El uso de antibióticos cada 11 pacientes previno 1 ISQ. Asimismo, la administración de profilaxis parece ser costo-efectiva. En consecuencia, los autores consideran que los resultados del presente ensayo justifican el uso preoperatorio de profilaxis antibiótica para la cirugía por cáncer de la mama en pacientes obesas. Como todas las ISQ de desarrollaron en pacientes con un IMC por encima de 30, la necesidad de administrar antibióticos profilácticos en pacientes con sobrepeso (25 ≤ IMC < 30), parece estar justificada.
Artículos relacionados
> El dolor de la fibromialgia implica mecanismos de amplificación central
> Evaluacion de los incidentalomas suprarrenales funcionales y malignos
> Evaluacion de los incidentalomas suprarrenales funcionales y malignos
Referencias bibliográficas
1. Blumberg, D., Port, J.L., Weksler, B. et al. Thymoma: a multivariate analysis of factors predicting survival. Ann Thorac Surg. 1995; 60: 908–914
2. Tseng, Y.L., Wang, S.T., Wu, M.H., Lin, M.Y., Lai, W.W., and Cheng, F.F. Thymic carcinoma: involvement of great vessels indicates poor prognosis. Ann Thorac Surg. 2003; 76: 1041–1045
3. Kondo, K. and Monden, Y. Therapy for thymic epithelial tumors: a clinical study of 1,320 patients from Japan. Ann Thorac Surg. 2003; 76: 878–885
4. Snover, D.C., Levine, G.D., and Rosai, J. Thymic carcinoma (Five distinctive histological variants) . Am J Surg Pathol. 1982; 6: 451–470
5. Levine, G.D. and Rosai, J. Thymic hyperplasia and neoplasia: a review of current concepts. Hum Pathol. 1978; 9: 495–515
6. Bergh, N.P., Gatzinsky, P., Larsson, S., Lundin, P., and Ridell, B. Tumors of the thymus and thymic region: I (Clinicopathological studies on thymomas) . Ann Thorac Surg. 1978; 25: 91–98
7. Liu, H.C., Hsu, W.H., Chen, Y.J. et al. Primary thymic carcinoma. Ann Thorac Surg. 2002; 73: 1076–1081
8. Maruyama, R., Suemitsu, R., Okamoto, T. et al. Persistent and aggressive treatment for thymic carcinoma (Results of a single-institute experience with 25 patients) . Oncology. 2006; 70: 325–329
9. Suster, S. and Rosai, J. Thymic carcinoma (A clinicopathologic study of 60 cases) . Cancer. 1991; 67: 1025–1032
10. Yano, M., Sasaki, H., Yokoyama, T. et al. Thymic carcinoma: 30 cases at a single institution. J Thorac Oncol. 2008; 3: 265–269
11. Hosaka, Y., Tsuchida, M., Toyabe, S., Umezu, H., Eimoto, T., and Hayashi, J. Masaoka stage and histologic grade predict prognosis in patients with thymic carcinoma. Ann Thorac Surg. 2010; 89: 912–917
12. Ogawa, K., Toita, T., Uno, T. et al. Treatment and prognosis of thymic carcinoma: a retrospective analysis of 40 cases. Cancer. 2002; 94: 3115–3119
13. Venuta, F., Anile, M., Diso, D. et al. Thymoma and thymic carcinoma. Eur J Cardiothorac Surg. 2010; 37: 13–25
14. Chung, D.A. Thymic carcinoma—analysis of nineteen clinicopathological studies. Thorac Cardiovasc Surg. 2000; 48: 114–119
15. Okumura, M., Ohta, M., Miyoshi, S. et al. Oncological significance of WHO histological thymoma classification (A clinical study based on 286 patients) . Jpn J Thorac Cardiovasc Surg. 2002; 50: 189–194
16. Kondo, K. Tumor-node metastasis staging system for thymic epithelial tumors. J Thorac Oncol. 2010; 5: S352–S356
17. Detterbeck, F.C. Clinical value of the WHO classification system of thymoma. Ann Thorac Surg. 2006; 81: 2328–2334
18. Yano, T., Hara, N., Ichinose, Y., Asoh, H., Yokoyama, H., and Ohta, M. Treatment and prognosis of primary thymic carcinoma. J Surg Oncol. 1993; 52: 255–258
19. Weide, L.G., Ulbright, T.M., Loehrer, P.J. Sr, and Williams, S.D. Thymic carcinoma (A distinct clinical entity responsive to chemotherapy) . Cancer. 1993; 71: 1219–1223
20. Carlson, R.W., Dorfman, R.F., and Sikic, B.I. Successful treatment of metastatic thymic carcinoma with cisplatin, vinblastine, bleomycin, and etoposide chemotherapy. Cancer. 1990; 66: 2092–2094
21. Masaoka, A. Staging system of thymoma. J Thorac Oncol. 2010; 5: S304–S312
22. Onuki, T., Ishikawa, S., Yamamoto, T. et al. Pathologic radioresponse of preoperatively irradiated invasive thymomas. J Thorac Oncol. 2008; 3: 270–276


No hay comentarios:
Publicar un comentario